)化合物F是合成某种抗肿瘤药物的重要中间体,其合成路线如图:

(1)A中的含氧官能团名称为硝基、 和 。
(2)B的结构简式为 。
(3)C→D的反应类型为 。
(4)C的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式 。
①能与FeCl3溶液发生显色反应。
②能发生水解反应,水解产物之一是α﹣氨基酸,另一产物分子中不同化学环境的氢原子数目比为1:1且含苯环。
(5)写出以CH3CH2CHO和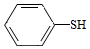 为原料制备
为原料制备 的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
[化学-一选修 5: 有机化学基础]
秸秆(含多糖物质)的综合应用具有重要的意义。下面是以秸秆为原料合成聚酯类高分子化 合物的路线:

回答下列问题:
(1)下列关于糖类的说法正确的是_ (填标号)
A. 糖类都有甜味, 具有 的通式
B. 麦芽糖水解生成互为同分异构体的葡萄糖和果糖
C. 用银镜反应不能判断淀粉水解是否完全
D. 淀粉和纤维素都属于多糖类天然高分子化合物
(2) 生成 的反应类型为 。
(3)D中官能团名称为______,D生成E的反应类型为______。
(4) 的化学名称是 , 由 生成 的化学方程式为 .
(5)具有一种官能团的二取代芳香化合物 是 的同分异构体, 与足量碳酸氢钠溶液反应生成 共有 种(不含立体结构 , 其中核磁共振氢谱为三组峰的结构简式为 .
(6) 参照上述合成路线,以(反,反)-2, 4-己二烯和 为原料(无机试剂任选 ), 设计制备对二苯二甲酸的合成路线_ 。
[化学一一选修3: 物质结构与性质]
锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1) 基态 Ge 原子的核外电子排布式为[Ar] ,有 个末成对电子。
(2) Ge 与 C 是同族元素, 原子之间可以形成双键、叁键, 但 原子之间难以形成双键或 叁键。从原子结构角度分析,原因是 。
(3)比较下列锗卤化物的熔点和沸点, 分析其变化规律及原因 。
|
|
|
|
|
|
熔点/ |
|
26 |
146 |
|
沸点/ |
|
186 |
约 400 |
(4) 光催化还原 制备 反应中,带状纳米 是该反应的良好催化剂。 、Ge、O 电负性由大至小的顺序是 。

(5) Ge 单晶具有金刚石型结构, 其中 原子的杂化方式为_ , 微粒之间存在的作用力是_ 。
(6)晶胞有两个基本要素:
①原子坐标参数, 表示晶胞内部各原子的相对位置, 下图为 Ge 单晶的晶胞, 其中原子坐标参数 为 为 为 。则 原子的坐标参数为 。
②晶胞参数, 描述晶胞的大小和形状,已知 Ge 单晶的晶胞参数 , 其密度为 (列出计算式即可)。
【化学ーー选修2:化学与技术】
高锰酸钾( )是一种常用氧化剂,主要用于化工、防腐及制药工业等。以软锰矿(主要成分为 )为原料生产高锰酸钾的工艺路线如下:

回答下列问题:
(1) 原料软锰矿与氢氧化钾按 的比例在 "烘炒锅"中混配,混配前应将软锰矿粉碎, 其作用是 。
(2) "平炉"中发生的化学方程式为 .
(3)"平炉"中需要加压,其目的是 。
(4) 将 转化为 的生产有两种工艺。
① 歧化法" 是传统工艺, 即在 溶液中通入 气体, 使体系呈中性或弱碱性,
发生歧化反应,反应中生成 和 (写化学式)。
② "电解法" 为现代工艺, 即电解 水溶液, 电解槽中阳极发生的电极反应为 , 阴极逸出的气体是_ 。
③ "电解法" 和 歧化法" 中, 的理论利用率之比为 _ 。
(5)高锰酸钾纯度的测定:称取 样品, 溶解后定容于 容量瓶中, 摇匀。取浓度为 的 标准溶液 , 加入稀硫酸酸化,用 溶液平行滴定三次, 平均消耗的体积为 , 该样品的纯度为 。
(列出计算式即可, 已知 ) 。
是一种重要的杀菌消毒剂, 也常用来漂白织物等, 其一种生产工艺如下:

回答下列问题:
(1) 中 的化合价为_ 。
(2) 写出 "反应"步骤中生成 的化学方程式 。
(3) "电解"所用食盐水由粗盐水精制而成, 精制时,为除去 和 , 要加入的试剂分别为 、 。"电解" 中阴极反应的主要产物是_ 。
(4) "尾气吸收"是吸收 "电解"过程排出的少量 。此吸收反应中, 氧化剂与还原剂的
物质的量之比为 ,该反应中氧化产物 。
(5)"有效氯含量"可用来衡量含氯消毒剂的消毒能力, 其定义是:每克含氯消毒剂的氧化
能力相当于多少克 的氧化能力。 的有效氯含量为 。(计算结果保留两位小数)
磁选后的炼铁高钛炉渣,主要成分有 、 、 、 、 以及少量的 。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。

该工艺条件下,有关金属离子开始沉淀和沉淀完全的pH见下表
|
金属离子 |
|
|
|
|
|
开始沉淀的pH |
2.2 |
3.5 |
9.5 |
12.4 |
|
沉淀完全 的pH |
3.2 |
4.7 |
11.1 |
13.8 |
回答下列问题:
(1)"焙烧"中, 、 几乎不发生反应, 、 、 、 转化为相应的硫酸盐。写出 转化为 的化学方程式 。
(2)"水浸"后"滤液"的 约为2.0,在"分步沉淀"时用氨水逐步调节 至11.6,依次析出的金属离子是 。
(3)"母液①"中 浓度为 。
(4)"水浸渣"在 "酸溶",最适合的酸是 。"酸溶渣"的成分是 、 。
(5)"酸溶"后,将溶液适当稀释并加热, 水解析出 沉淀,该反应的离子方程式是 。
(6)将"母液①"和"母液②"混合,吸收尾气,经处理得 ,循环利用。