一种高性能的碱性硼化钒(VB2 )﹣﹣空气电池如图所示,其中在VB2电极发生反应:VB2+16OH﹣﹣11e﹣═VO43﹣+2B(OH)4﹣+4H2O该电池工作时,下列说法错误的是( )

A.负载通过0.04mol电子时,有0.224L (标准状况)O2参与反应
B.正极区溶液的pH降低、负极区溶液的pH升高
C.电池总反应为4VB2+11O2+20OH﹣+6H2O═8B(OH)4﹣+4VO43﹣
D.电流由复合碳电极经负载、VB2电极、KOH溶液回到复合碳电极
下列说法正确的是
①具有规则几何外形的固体一定是晶体
②NaCl晶体中与每个Na+距离相等且最近的Na+共有12个
③非极性分子中一定含有非极性键
④晶格能由大到小: NaF> NaCl> NaBr>NaI
⑤含有共价键的晶体一定具有高的熔、沸点及硬度
⑥s-s σ键与s-p σ键的电子云形状相同
⑦含有π键的化合物与只含σ键的化合物的化学性质不同
⑧中心原子采取sp3杂化的分子,其立体构形不一定是正四面体
| A.①②⑤⑥ | B.③④⑥⑦ | C.②④⑦⑧ | D.③④⑤⑧ |
以下是一些原子的2p能级和3d能级中电子排布的情况。其中违反了洪特规则的是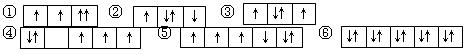
| A.① | B.①③ | C.②④⑤ | D.③④⑤ |
冶金工业上常用电解熔融MgCl2而不用电解MgO的方法制取镁,其原因是
| A.熔融的MgO不导电 | B.MgO分子间作用力很大 |
| C.MgO熔点高 | D.MgO属原子晶体 |
活性炭可处理大气污染物NO。在2 L密闭容器中加入NO和活性炭(无杂质),反应方程式为NO+C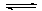 E+F(未配平)。当温度为T时,经过5 min达到平衡,测得平衡时各物质的物质的量如下表:
E+F(未配平)。当温度为T时,经过5 min达到平衡,测得平衡时各物质的物质的量如下表:
| 活性炭 |
NO |
E |
F |
|
| 初始时(mol) |
2.050 |
0.200 |
0 |
0 |
| 平衡时(mol) |
2.000 |
0.100 |
0.050 |
0.050 |
则下列说法正确的是
A.该反应的平衡常数为1/4
B.增加活性炭的量,能缩短达到平衡所用的时间
C.容器中压强不变可以说明该反应达到平衡状态
D.达到平衡时,用E表示该反应的速率为0.01 mol·L-1·min-1
常温下,0.1mol·L-1某一元酸(HA)溶液中c(OH-)/c(H+)=1×10-8,相同物质的量浓度的某一元碱(BOH)溶液中c(OH-)/c(H+)=1×1012,下列叙述正确的是
A.HA的pH=3;BOH的pH=13
B.pH=a的HA溶液,稀释10倍,其pH=a+1
C.等体积的HA和BOH恰好完全反应,溶液的pH=7
D.相同体积相同pH的HA和盐酸分别与足量Zn反应,生成氢气的物质的量相同