绿色环保是未来工业发展的方向,我市锰矿资源丰富,某电解锰厂排放的废液中可能含有少量硫酸,某校兴趣小组同学取该废液样品100g,加入某碱性M物质充分反应后得到的相关数据如图(废液中其它物质不与M物质反应)。请根据相关知识和图表信息回答下列问题。
(1)从经济和效果考虑,该电解锰厂应选择什么物质除去废液中硫酸?
(2)该反应的基本类型是 。
(3)计算废液中硫酸的质量分数(写出计算过程)。

工业上用赤铁矿石(主要成分是氧化铁)与一氧化碳在高温条件下冶炼生铁。现有400t含氧化铁80%的赤铁矿石。
求:(1)该矿石中氧化铁的质量。
(2)该矿石能冶炼出含杂质4%的生铁的质量。(计算结果精确到0.1)
将12.5g含碳酸钙80%的石灰石与50g稀盐酸放入同一烧杯中混合,二者恰好完全反应(杂质不溶于水,也不参与反应).请计算:反应后所得溶液的溶质质量分数(结果保留到1%)
木糖醇(化学式为C5H12O5)可用作甜味剂,广泛应用于化工、医药等工业.请计算:
(1)木糖醇中碳、氢、氧三种元素的原子个数比为 .
(2)木糖醇所含的元素中质量分数最大的是 .
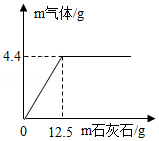
向盛有一定质量稀盐酸的烧杯中逐渐加入石灰石,产生气体质量与石灰石质量的关系如图所示。恰好完全反应后称得烧杯中剩余物质质量为108.1g,请根据关系图分析并计算:
(1)稀盐酸完全反应时,产生CO2气体的质量为 g,消耗CaCO3的质量为 g。
(2)该稀盐酸溶质的质量分数。(写出计算过程,结果保留至0.1%)
某工厂排放的废水中含有亚硫酸钠(Na2SO3)未经处理,会造成污染,化学兴趣小组的同学对废水处理设计了如图所示的实验方案:

试计算:
(1)反应前后生成亚硫酸钙沉淀的质量为 g。
(2)废水中亚硫酸钠的质量分数(请写出计算过程)。
(温馨提示:Na2SO3+CaCl2═CaSO3↓+2NaCl;氯化钙不与废水中的其它杂质反应)