水是生命之源,是人类宝贵的自然资源。
Ⅰ.节约用水
(1)如图所示图标是我国“国家节水标志”的是 (填字母)。

Ⅱ.水的净化
天然水净化为自来水的主要流程如图所示:

(2)“沉降池”中可用明矾作混凝剂,其化学式为KAl(SO4)n•12H2O,n的值为 。
(3)“吸附池”中常用 (填物质名称)吸附色素和异味。
(4)“消毒池”中常用液氯作消毒剂,发生了反应:Cl2+H2O═HCl+HClO。若用自来水直接配制硝酸银溶液会产生氯化银白色沉淀。写出盐酸与硝酸银溶液反应的化学方程式: 。
Ⅲ.废水处理
(5)废水中氨氮(以NH3形式存在)含量过高,直接排放会导致水体富营养化。次氯酸(HClO)可除去废水中的NH3,发生的反应为:2NH3+3HClO═X+3HCl+3H2O。X的化学式为 。若废水碱性过强(pH>10),NH3的去除率会显著降低,原因是 。
实验室现有氯酸钾、二氧化锰、稀硫酸、石灰石、稀盐酸、锌粒以及如图仪器及装置,据图回答问题:

(1)利用上述仪器和药品制取CO2,选择的仪器是 (填序号)。
(2)利用上述仪器和药品制取O2,还缺少一种仪器,其名称为 。该反应的化学方程式为 。
(3)如果用装置⑨采用排空气法收集H2,则H2从导管口 进入(填“a”或“b”)。
以黄铜矿(主要成分为CuFeS2)为原料,采用生物炼铜是现代炼铜的新工艺,同时还可以获得绿矾(FeSO4•7H2O),流程如图:

(1)步骤①中的化学方程式:4CuFeS2+17O2+2H2SO4 4CuSO4+2Fe2(SO4)3+ 。
4CuSO4+2Fe2(SO4)3+ 。
(2)步骤②中的反应有两个:反应一是Fe+Fe2(SO4)3═3FeSO4,该反应属于 (填基本反应类型),反应二的化学方程式为 。
(3)加入的A是 (填化学式)。
(4)获得绿矾的“一系列操作”为:蒸发浓缩、 、过滤等。
某班同学在做“某些酸、碱、盐之间是否发生反应”的探究实验时发现,酸碱之间的反应,往往没有明显的现象。那么如何判断酸碱发生了化学反应呢?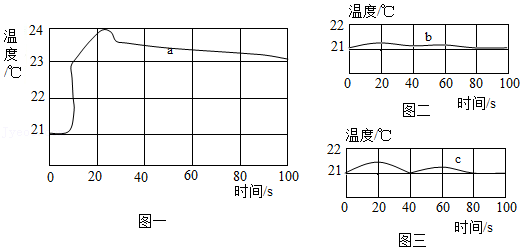
【提出问题】如何判断酸、碱溶液发生了化学反应?
【实验药品】一定质量分数的稀盐酸、一定质量分数的氢氧化钠溶液(稀)、酚酞溶液、蒸馏水。
【实验探究】
(1)甲小组在烧杯中加入50mL氢氧化钠溶液,滴入几滴酚酞溶液,用滴管慢慢滴入稀盐酸,发现 (填现象),证明氢氧化钠溶液与稀盐酸发生了化学反应,该反应的化学方程式为 。
(2)乙小组进行了以下三个实验,并用温度传感器测定实验过程中的温度变化情况,得到了如图所示的三条曲线。
实验一:50mL稀盐酸与50mL氢氧化钠溶液混合(曲线a);
实验二:50mL稀盐酸与50mL蒸馏水混合(曲线b);
实验三:50mL氢氧化钠溶液与50mL蒸馏水混合(曲线c)。
结合实验目的分析,增加实验二、实验三的目的是 。
对比三条曲线,可以得到如下结论:
①氢氧化钠溶液和稀盐酸一定发生了化学反应。
②酸碱中和反应是 反应(填“放热”或“吸热”)。
【交流与反思】
(3)甲小组认为,通过实验探究(2)得出“中和反应是放热反应”的结论不严谨,应该补充 实验。
如图是实验室常用的实验装置,请回答下列问题。

(1)图中仪器a的名称为 。
(2)若用装置B制取氧气,相应反应的化学方程式为 ,若用此法制备并收集干燥的氧气,则装置的连接顺序为B→ → 。
(3)实验室用装置A、F进行碳还原氧化铜的实验,为了检验反应的产物,装置F中应盛放的试剂是 ,反应过程中该装置内的现象为 。
请你根据所学知识并结合如图所示装置回答有关问题。

(1)装置D中仪器a的名称是 。
(2)实验室用装置B制取氧气,反应的化学方程式为 。
(3)实验室制取氢气选用的装置组合是 。
(4)若用F装置收集二氧化碳.气体应从 (填“m”或“n”)端通入。