铜及其化合物在生产生活中有重要应用。某同学对铜及某些含铜物质进行探究。
[温故如新](1)在①CuO②Cu(OH)2③CuCl2④Cu2(OH)2CO3[也可表示为CuCO3•Cu(OH)2]这4种物质中,属于碱的有 (填序号));除①CuO外,其余3种物质在常温下易溶于水有 (填序号)。
(2)考古出土的春秋末期制造的青铜剑,历经2500余年,其表面且有一层薄锈,但仍寒光逼人,剑刃锋利。由此可知,青铜具有的特性有 (任写一条)。铜器表面的薄锈是铜与空气中的氧气、水、 等物质发生反应所形成。
[提出问题]除H2、CO能还原CuO外,是否还有其他气体能够还原CuO得到金属铜?怎样从含CuCl2、FeCl3的某工业废液中回收金属铜和FeCl2溶液?
[查阅资料]a.通常状况下,氨气极易溶于水形成溶液;加热时,氨气能与CuO反应生成氮气和金属铜等,可用如图所示装置验证。b.在溶液中能发生反应2FeCl3+Fe═3FeCl2。
[进行实验1](3)按图示连接装置,检查气密性后,加(通)入相关药品,后续操作均按规范要求进行,完成实验。
①将CuO粉末装入玻璃管A中的具体操作方法是 。
②实验时,在试管B中能够观察到的现象是有液体出现,该液体是 (填“纯净物”或“混合物”)。
③从环保角度看该装置的不足之处是 。
[进行实验2](4)取适量含CuCl2、FeCl3的某工业废液样品,向其中加入过量铁粉并充分反应后,过滤,将滤渣和足量 (填“稀盐酸”或“稀硫酸”)充分反应,再
(填操作名称)、洗涤、干燥即可回收得到金属铜;所得滤液中含有需要回收的FeCl2。
[拓展延伸](5)已知:加热时,葡萄糖溶液与氢氧化铜悬浊液能发生反应。实验室可用CuSO4溶液等物质检验葡萄糖的存在,具体实验过程为:在试管中加入2mL 10%NaOH溶液,滴加5% CuSO4溶液5滴(每滴溶液按0.04mL计算。两种溶液的密度均按1g/mL计算),混合均匀,充分反应,得混合物A。再向上述试管中加入几滴10%葡萄糖溶液,并在酒精灯上加热至沸腾,片刻后生成红色沉淀B,检验完成。则混合物A显 (填“中性”或“碱性”);红色沉淀B是 [填“CuO”或“Cu2O”“或“Cu(OH)2”]。

一种名为“污渍爆炸盐”的洗涤产品能高效去除衣物上的顽固污渍,某校化学研究性学习小组的同学在老师的指导下对该产品开展了以下探究活动.
【查阅资料】“污渍爆炸盐”的主要成分是过碳酸钠(相对分子质量为122),它是一种白色固体粉末,易溶于水且能与水反应生成一种碳酸盐和一种强氧化性的物质,是当前使用最为广泛的洗涤助剂之一.
【实验探究一】过碳酸钠的化学组成
为探究过碳酸钠的化学组成,同学们设计了以下实验,请按要求完成表格内容:
| 序号 |
实验步骤 |
实验现象 |
实验分步结论(或解释) |
| ① |
向盛有过碳酸钠固体的试管中加入适量水 |
固体溶解 |
|
| ② |
向序号①的所得溶液中加入适量的二氧化锰粉末 |
有大量气泡产生 |
|
| ③ |
将带火星的木条置于试管口 |
木条复燃 |
序号②试管中产生的气体是 ;过碳酸钠溶于水能生成 (填化学式). |
| ④ |
取序号③试管中的上层清液加入氯化钙溶液 |
产生白色沉淀 |
反应的化学方程式 . |
| 实验 小结 |
过碳酸钠的化学式是 ; 过碳酸钠与水反应的化学方程式是 . |
||
【实验探究二】过碳酸钠含量测定
老师给同学们一份含碳酸钠杂质的过碳酸钠样品(不含其它杂质),要求设计方案测定该样品中过碳酸钠的含量,同学们经讨论设计了如图所示的实验装置.图中装置B盛装氢氧化钠溶液、C盛装澄清石灰水、D盛装浓硫酸,E、F均装入干燥的碱石灰(主要成分:氧化钙和氢氧化钠的固体混合物;可吸收二氧化碳和水蒸气).
(1)首先关闭活塞K、K2,打开活塞K1、K3、K4,通入一段时间的氮气排出锥形瓶中的空气,此时装置B的作用是 ;
(2)依次关闭活塞K1、K3、K4,打开活塞K2、K,此时锥形瓶中反应生成的气体是 ,E中装入碱石灰的作用是 ,反应完全后关闭活塞K,再次打开活塞K1通入氮气的作用是 ;
(3)同学们根据E装置在测定前后的质量差计算出了样品中过碳酸钠的含量.装置F的作用是 ,如不连接装置F,测定的过碳酸钠含量会 (填“偏高”或“偏低”).
在中学所学的化学反应中,有很多反应没有明显现象.某探究小组想通过实验来证明某些无现象的反应确实发生了,他们做了以下探究过程.
Ⅰ,对NaOH溶液与盐酸反应的探究
甲同学按如图所示的装置验证NaOH与盐酸发生反应,结果甲同学没有看到预期的实验现象,原因是 ,如果要想证明盐酸与NaOH发生反应,则实验应改为 现象.
Ⅱ,对CO2与NaOH溶液反应的探究
【查阅资料】通常状况下,1体积水能溶解1体积二氧化碳.
【设计实验】甲同学设计了三个实验进行验证,请你帮他完成下列实验报告.
| 实验操作 |
实验现象 |
实验结论及解释 |
|
| ① |
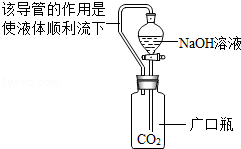 |
氢氧化钠溶液可以与CO2反应. 反应的化学方程式为: |
|
| ② |
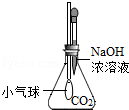 |
氢氧化钠溶液可以与CO2反应. |
|
| ③ |
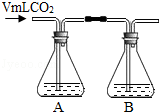 洗气瓶中的溶液均为氢氧化钠溶液或澄清石灰水(均为200mL) |
A,B均无明显变化 |
氢氧化钠溶液可以与CO2反应. B中盛放的溶液是 澄清石灰水 . |
【反思交流】
(1)实验①由于甲同学选用的仪器不当,导致未能观察到明显现象,乙同学将甲同学的广口瓶替换成 ,看到了 现象,证明CO2可以与NaOH溶液反应.丙同学认为乙同学的改进实验仍然存在缺陷,应增加一个对比实验,证明CO2确实可以与NaOH溶液发生反应,该对比实验所用的试剂是 .
(2)请判断③中V 00mL(填“>”、“<”或“=”),理由是 .
【实验结论】通过实验探究,证明了氢氧化钠溶液可以与二氧化碳反应.
已知木炭还原氧化铜实验中发生的主要反应:C+2CuO 2Cu+CO2↑.化学兴趣小组对该实验产物(假设反应物已完全反应)作如下探究:
2Cu+CO2↑.化学兴趣小组对该实验产物(假设反应物已完全反应)作如下探究:
探究一:检验产物的成份
【提出问题】实验产物是暗红色固体,很难观察到紫红色固体.暗红色固体是什么?
【查阅资料】氧化亚铜(Cu2O)为红色固体;Cu2O+H2SO4═CuSO4+Cu+H2O.
【猜想与假设】暗红色固体除铜外还可能含有Cu2O.
【设计实验】取少量暗红色固体,加入稀硫酸,如果观察到现象: ,说明暗红色固体含有Cu2O.
探究二:测定产物中Cu2O的含量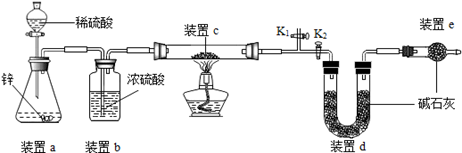
原理:Cu2O+H2 2Cu+H2O,称取一定质量的固体样品,用如图装置进行实验(固定装置略去,碱石灰为氧化钙和氢氧化钠的混合物),通过测定反应前后装置d的质量达到实验目的.
2Cu+H2O,称取一定质量的固体样品,用如图装置进行实验(固定装置略去,碱石灰为氧化钙和氢氧化钠的混合物),通过测定反应前后装置d的质量达到实验目的.
(1)装置a中用稀硫酸而不用稀盐酸,原因是 ;
(2)若不加装置e,实验结果会偏高,原因是 ;
(3)点燃酒精灯前涉及的部分操作如下,正确的顺序是 ;
①打开K2,关闭K1
②检查装置的气密性
③连接仪器
④关闭K2,打开K1,通氢气一段时间
(4)还可通过测定反应前后装置 (填“a”、“b”或“c”)的质量达到实验目的.
煤的综合利用是将煤隔绝空气加强热,使煤分解成许多有用的物质,煤气是其中一种。煤气的主要成分是什么呢?某兴趣小组为此展开了探究。
【查阅资料】(1)煤气中可能含有 CO、CO2、H2、CH4中的一种或几种。
(2)常温下,氯化钯(PdCl2)溶液吸收 CO 时发生的化学反应方程式为:
CO +PdCl2+H2O  CO2+Pd↓(灰色) +2HCl
CO2+Pd↓(灰色) +2HCl
【实验方案】兴趣小组的同学设计如下装置探究煤气中的成分。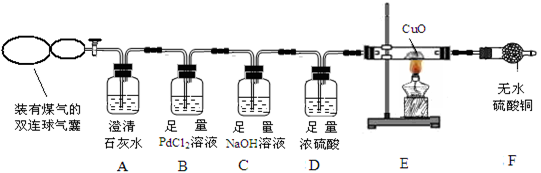
【交流讨论】请回答实验中的有关问题:
(1)实验开始后,A 中无明显现象,说明煤气中不存在____________________;
(2)若煤气中有 CO 存在,则 B中产生的现象是 ;
(3)写出 C 中发生反应的化学方程式__________________________(写一个即可);
D 中浓硫酸的作用是_________________________。
(4)若 F 中无水CuSO4变蓝色,则E中一定发生的化学方程式为 ;
(5)点燃F装置导出的气体,有火焰产生。江枫认为煤气中含 CH4,理由是CH4可以燃烧,CH4燃烧的化学方程式是___________________,老师则认为不能确认煤气中含有 CH4,理由是______________________。为了确定煤气中是否有CH4,老师接着采取的操作方法是 ;观察到的现象是___________________________________。由此验证煤气中一定含有CH4。
碳酸氢钠是一种重要的盐类物质,在生活中用途广泛.小滨同学设计了实验,以探究碳酸氢钠的化学性质.
【探究实验1】碳酸氢钠溶液的酸碱性
【实验方案】取少量该固体加入试管中,加适量水溶解,再滴入几滴酚酞实验,震荡.
现象:溶液变成浅红色.由此得出结论;
【探究实验2】能与酸反应
【实验方案】取少量该固体加入试管中,滴加稀盐酸,现象为;
【探究实验3】碳酸氢钠的热稳定性
【实验方案】用如图所示装置进行实验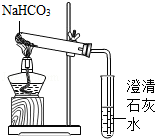
现象:充分加热后,大试管口有水珠出现,管底有白色固体残留,小试管中澄清石灰石变浑浊.
结论:碳酸氢钠受热能生成二氧化碳、水和一种白色固体.
验证:(1)请你帮小滨设计实验,证明试管中留下的白色固体是Na2CO3,而不是NaOH(所选试剂不能用酸).
步骤,现象;
(2)写出碳酸氢钠受热分解的化学方程式;
【拓展应用】试说出碳酸氢钠在日常生活中的一种用途.