水是一种常见的溶剂,也是重要的资源。
(1)实验室用NaCl固体配制50g 15% NaCl溶液。
①使用托盘天平称取 g NaCl固体。
②溶解过程中需要用到的玻璃仪器有烧杯、量筒、胶头滴管和 (填仪器名称)。
(2)大多数天然淡水需要经过处理方可直接饮用。
①工厂锅炉长期使用会形成水垢,可用盐酸去除。写出水垢中Mg2(OH)2CO3溶于盐酸时发生反应的化学方程式 。
②某家用净水机工作原理如图所示:

净水机中,PP棉净水原理是 (填“过滤”或“蒸馏”)。颗粒活性炭可去除异味和余氯,是因为活性炭具有良好的 性。
(3)扬州积极推进水环境整治,建设“秀美瘦西湖,文明新扬州”。
①环保部门对水质进行长期监测,将水质从“优”到“劣”分为I~V类。由如图可知,近年来扬州市Ⅱ~Ⅲ类优良水质百分比明显呈 (填“上升”或“下降”)趋势。由此推断,扬州市主要水域的水质在 (填“变好”或“变差”)。

②产生这种变化趋势的原因可能是 (填字母)。
A.夜间排放工业污水
B.清理污染河道的淤泥
C.关停或整改存在污染隐患的企业
(4)污水未经处理直接排入河流,会使水面上藻类物质大量繁殖,水质恶化。某藻类含化学式为C106H263O106N16P的物质,则污水中导致藻类生长过快的营养元素是 (填元素名称)。
科学家研究利用海水处理、回收废气中二氧化硫,其流程如下(序号表示化学反应):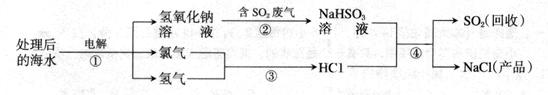 (1) 写出反应①的化学方程式。
(1) 写出反应①的化学方程式。
(2) SO2和CO2的化学性质相似。用氢氧化钠溶液吸收SO2时除生成NaHSO3外还可能生成
(写化学式)。
(3) 反应④中发生反应的离子是。
(4)现有含二氧化硫的废气a g,经过氢氧化钠溶液充分吸收后得到亚硫酸氢钠,消耗氢氧化钠b g,通过计算求二氧化硫在废气中百分含量。
MnO2是一种重要的无机功能材料,粗Mn02(含有较多的Mn0和MnC03)的提纯是工业生产的重要环节。下图是某研究性学习小组在实验室中模拟工业上粗Mn02转化为纯Mn02的工艺流程。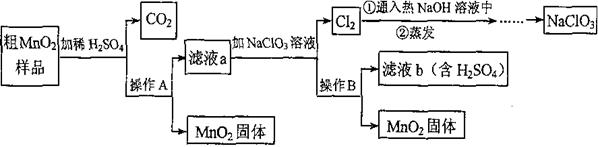 请回答下列问题:
请回答下列问题:
(1)NaCl03中氯元素的化合价为价。
(2)操作A的名称是。
(3)蒸发所需的仪器有铁架台(带铁圈)、玻璃棒、酒精灯和 ;其中玻璃棒作用是。
(4)写出粗MnO2样品加稀H2SO4时产生C02的化学方程式。
(5)该流程中可以循环利用的物质是H2SO4和 。
下面是实验室制取和收集气体的装置,请按要求作答:
某兴趣小组利用下图装置探究制取气体的原理、方法及性质。结合装置图,回答问题: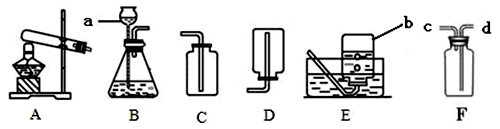
(1)写出图中标号仪器的名称:a:,b:
(2)实验室准备用高锰酸钾制取比较纯净的氧气,采用的装置组合是,该反应的化学方程式为;利用氯酸钾和二氧化锰的混合物制取O2后的固体残渣(假定已完全反应),通过以下四步实验操作可回收二氧化锰。正确操作的先后顺序是(填写选项序号)。
a.烘干 b.溶解 c.过滤 d.洗涤
(3)该小组想用B装置来制取CO2,所用药品名称为和;
该反应的化学方程式为;收集 CO2前,如果用F装置中的某种溶液干燥CO2,则该溶液是;CO2应从F装置的端通入。
(4)该小组在制取CO2的时侯,发现二氧化碳收集好后,反应仍在发生,所以,他们想设计一个能随时控制反应的发生与停止的装置,你觉得右边Ⅰ、Ⅱ、Ⅲ装置中能实现上述意图的是。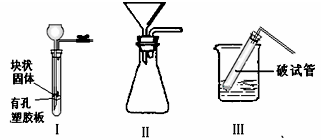
物质的化学变化
物质世界时时刻刻都在发生着变化。自然界中物质的变化通常分为两大类,即物理变化和化学变化。
(1)化学变化区别于物理变化的本质特征是;
(2)化学变化是有条件的,并且是可以控制的。人们在科学实验和日常生活中就有许多控制化学变化的事例。请参照举例,从化学角度说明下列事例中人们是控制化学变化的原理。
| 编号 |
事例 |
原理 |
| 举例 |
厨房中油锅着火,用锅盖盖灭 |
隔绝空气,使燃烧反应停止 |
| 事例1 |
实验室用过氧化氢制氧气时加入二氧化锰 |
|
| 事例2 |
易变质的食品采用真空包装,可以延长保质期 |
|
| 事例3 |
夏天,为防止食物变质,放在冰箱中 |
|
| 事例4 |
用鼓风机向煤炉中吹入空气,可以使炉火更旺 |
写出下列反应的化学方程式,并指明基本反应的类型。
(1)镁条在氧气中燃烧 ( )
(2)铁在氧气中燃烧 ( )
(3) 电解水 ( )
(4)实验室制氧气 ( )
(5) 红磷燃烧 ( )