同学们学习了复分解反应发生的条件后,利用所学知识对稀盐酸与如图中的三种物质之间能否发生反应作出判断,并进行实验验证:
组别 |
甲 |
乙 |
丙 |
实验示意图 |
|
|
|
能否反应 |
能 |
能 |
能 |
实验现象 |
无明显现象 |
有气泡产生 |
产生白色沉淀 |
同学们判断Ca(OH)2溶液和稀盐酸能发生化学反应的依据是生成物中有 生成。
【提出问题】
怎样证明Ca(OH)2溶液与稀盐酸发生了反应?
【分析讨论】
同学们经过讨论后认为,如果盐酸和氢氧化钙减少(或消失),或者有新物质生成,都能证明反应已经发生。
【查阅资料】
CaCl2溶液呈中性。
【实验探究】
方案 |
实验操作 |
实验现象 |
实验结论 |
方案一 |
小羽取少量Ca(OH)2溶液于试管中,先滴入2~3滴无色酚酞溶液,再加入稀盐酸 |
|
反应物消失,二者发生了反应 |
方案二 |
小美向甲组反应后的溶液中加入适量AgNO3溶液 |
产生白色沉淀 |
有新物质生成,二者发生了反应 |
【实验评价】
小凯认为小美的结论不正确,理由是 。
【总结归纳】
(1)Ca(OH)2溶液与稀盐酸发生了化学反应,其反应的化学方程式为 。
(2)对于无明显现象的反应,我们可以分析比较反应物和生成物的性质,从多个角度设计实验进行证明。
【拓展延伸】
将少量CO2通入NaOH溶液中也无明显现象,请你设计一个实验方案证明二者发生了反应 (写出操作方法和现象)。
同学们都知道
溶液呈蓝色,那么,你们知道是溶液中什么微粒使
溶液呈蓝色吗?
基于初中所学知识,下面主要采用不同的思维方式对该问题进行探讨.
(说明:以下溶液皆为稀溶液,在稀溶液中
、
呈无色.)
思路一:采用归纳法,由具体事实推理概括出一般原理或结论.
下图一:请比较A、B、C、D、E五支试管中所盛试剂的颜色与所含微粒,进行分析.
对 A、B、C的分析是:,说明
的存在使
、
溶液显蓝色.
对分析,可以说明,在水溶液中,
是无色的.
对A、D的分析是:,说明A中是
使
溶液显蓝色.对B、E分析同理.
对A、B、C、D、E 还可推理:水是无色液体,作为溶剂,溶解
、
等物质时,溶液的颜色主要受溶质的影响.
思路二:采用加入试剂发生化学反应的方法将溶液中的
除去或保持溶液中
的存在,观察溶液颜色是否变化的方法.
例1:如图二所示的方法是除去溶液中的
.该反应的化学方程式为:.
例2:请选择一种试剂与
溶液反应,保持溶液中
的存在.其化学方程式是:.
上述研究方法是用不同的思维方式,从不同的切入点研究同一个问题,但总体思路仍然是对比实验设计的一般思路.
某学习小组做镁带在空气中燃烧实验时,发现生成物中有黑色固体.针对这一现象,他们开展了如下探究活动.请仔细阅读并完成下列探究报告.
【探究目的】探究镁在空气中燃烧产生的黑色固体是镁与空气中什么物质反应产生的.
【分析猜想】分析空气中各种成分,寻找猜想依据.
空气成分之一:,化学性质稳定,一般不与其它物质反应.
空气成分之二:氧气,与镁反应生成的氧化镁是色固体.
空气成分之三:水蒸气,打磨光亮的镁带放入沸水中,表面会附有白色固体并产生大量气泡;再向沸水中滴入无色酚酞试液,呈现红色.则镁在沸水中反应的化学方程式为:.如果将镁带放到水蒸气中,也会发生上述反应,但产生的不是黑色固体.
空气成分之四:氮气、二氧化碳.猜想:可能是镁与
反应生成黑色固体.
【实验一】镁带与氮气的反应
(一)获取氮气
(1)把空气液化,然后蒸发,先蒸发出来的气体就是氮气.这种方法属于(选填"物理"或"化学")方法.但在实验室里空气不易被液化.
(2)以下是获取氮气的方法及装置,其中得到氮气较纯的是.(填字母)
(二)燃烧镁带,观察现象
将镁带打磨光亮,点燃,伸入盛
的集气瓶中,瓶内壁附着一层淡黄色的固体.
(三)实验结论:镁与氮气在点燃的条件下发生化合反应生成淡黄色的氮化镁.该反应
的化学方程式是.
【实验二】将燃着的镁带伸入盛
的集气瓶中,镁带剧烈燃烧,瓶内出现白色固体和黑色固体.
与镁发生了置换反应,生成的黑色固体物质是.
【探究结论】镁在空气中燃烧产生的黑色固体是镁与空气中
反应产生的.
酸雨往往含有硫酸、盐酸和硝酸等三种成分,但地区不同,成分也不同,要治理酸雨,先要确定其组成,兴趣小组对当地的酸雨进行探究,请你参与探究过程:
(1)若要确定该地区酸雨的
,最简便的方法是使用 ;
(2)设计实验方案,探究该地区酸雨是否存在硫酸和盐酸,填写下来.(已知硫酸银微溶于水.)限选试剂:
溶液、
溶液、
溶液、
溶液
| 实验步骤 |
预期现象与结论 |
| 步骤1:取适量的溶液于试管中, . |
|
| 步骤2:取适量步骤1中的上层清液与试管中, . |
英国科学家法拉第在《蜡烛的故事》系列讲座中,对蜡烛燃烧所涉及的知识进行了全面介绍。生产蜡烛的主要原料是石蜡和少量的硬脂酸添加剂等有机物,现在让我们一起对蜡烛原料的组成元素进行探究。
【提出问题】生产蜡烛的原料中主要有哪些元素?
【假设与猜想】主要原料为有机物,猜想:①一定有元素;②可能还有氢元素和氧元素。
【实验设计】根据上述三种元素的猜想制订实验方案。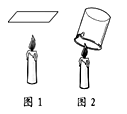
(1)如图1所示,在蜡烛火焰上方放置一块洁净、干燥的玻璃片,一会儿观察到玻璃片上生成一些细小的水珠。
(2)如图2所示,在蜡烛火焰上方罩一个内壁附着有的烧杯,观察现象。
【证据与结论】
实验(1),观察到玻璃片上有细小水珠时,说明原料中一定存在(填元素符号)。
实验(2),观察到烧杯内壁附着的,则猜想①成立。
【分析与交流】实验(1)和实验(2)获得的证据均不能证明原料中一定存在元素,因为。
某探究小组拟在实验室用下图所示装置和药品制取气体: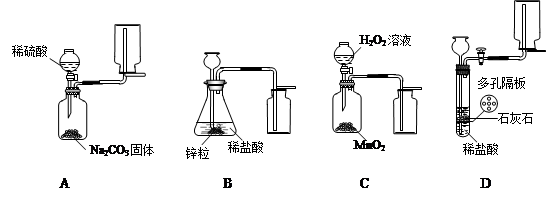
请回答下列问题:
(1)A装置中收集气体的仪器名称是。
(2)能够实现气体发生和收集的正确装置是。该装置中制气体的反应方程式是。
(3)某研究小组拟用装置A中的发生装置产生
。实验时需要溶质质量分数为9.8%的稀硫酸138g,则需要用量筒一次性量取溶质质量分数为98%,密度为1.84g/mL的浓硫酸mL(准确到小数点后一位),才能配制出该稀硫酸。