某学习小组对铁锈蚀进行探究。
【提出问题】铁锈蚀与哪些因素有关?
【查阅资料】
1.氯化钙固体可作干燥剂。
2.一定条件下,碳可加快铁的锈蚀,但碳本身不参加反应。
3.常温常压,氢气密度是dg/mL。
【设计与实验】
实验一:定性探究铁锈蚀的因素
取四枚相同的洁净无锈铁钉分别放入试管,进行图1实验,现象如表1。

表1
试管 |
一周后现象 |
A |
铁钉表面有一层铁锈 |
B |
铁钉表面无明显变化 |
C |
铁钉表面无明显变化 |
D |
铁钉表面有较厚铁锈 |
(1)对比A、B、C试管中实验现象,说明铁锈蚀主要是与空气中的 发生化学反应。
(2)对比A、D试管中实验现象,说明铁锈蚀还与 有关。
(3)铁锈蚀后应及时除锈的原因是 。写出除铁锈的化学方程式 。
实验二:定量探究铁锈蚀的因素
小组设计了图2装置,检查气密性,将5g铁粉和2g碳粉加入三颈烧瓶,t1时刻加入2mL饱和NaCl溶液后,再将一只装有5mL稀盐酸的注射器插到烧瓶上,采集数据。

(4)据图3,t2时刻后反应并未停止温度却开始降低,原因是 。
(5)据图4,对比AB段和BC段说明 ,分析t3时刻后压强突然变大的原因是 。
实验三:测定铁锈含量
将实验二烧瓶中剩余物质过滤、洗涤、干燥,得mg固体,连接图5装置,检查气密性,加入固体与足量稀盐酸进行实验。

(6)完全反应后,常温常压下测得生成气体体积为VmL,则该固体中铁锈质量分数表达式为 。
(7)该实验条件下测得铁锈质量分数偏小的原因是 ,解决方法是 。
【反思与评价】
(8)与实验一对比,实验二铁锈蚀明显更快的原因是 。
反思、归纳与提升是化学学习的重要方法.
对于复分解反应及其规律,通过反恩与探索,同学们有了新的认识.请填写下文中横线上的空白.
[知识回顾]
(1)氯化氢气体、氢氧化钠固体不导电.
(2)盐酸、氢氧化钠溶液能导电.
[分析归纳]
氯化氢溶于水:HCl H++Cl-
H++Cl-
氢氧化钠溶于水:NaOH Na++OH-
Na++OH-
结论:溶液导电是由于溶液中存在自由移动的离子.
[迁移运用]硫酸钠溶液能导电,原因是硫酸钠溶于水:Na2SO4 ________.
________.
[探索发现]
(1)氢氧化钠溶液与盐酸反应的微观示意图
[分析归纳]
反应的化学方程式:________________________.
反应的实质:H++OH- H2O,反应能进行的原因是溶液中H+和OH-的数目减少,即自由移动的离子数目减少.
H2O,反应能进行的原因是溶液中H+和OH-的数目减少,即自由移动的离子数目减少.
(2)硫酸钠溶液跟氯化钡溶液反应的微观示意图:
[分析归纳]
反应的化学方程式:________________________.
反应的实质:略.
反应能进行的原因是溶液中________________________的数目减少,即自由移动的离子数目减少.
(提示:该反应有硫酸钡白色沉淀生成)
(3)有气体生成的复分解反应,以Na2CO3+2HCl=2NaCl+H2O+CO2↑为例,反应实质:2H++
 ________.
________.
[总结规律]
上述复分解反应能发生的本质原因是________________________________________
________________________________________________________________________.
“侯氏制碱法”首先得到的是碳酸氢钠,然后将碳酸氢钠加热分解得到产品碳酸钠:2NaHCO3 Na2CO3+CO2↑+H2O.碳酸钠露置在空气中能与空气中的二氧化碳和水反应生成碳酸氢钠:Na2CO3+CO2+H2O=2NaHCO3.
Na2CO3+CO2↑+H2O.碳酸钠露置在空气中能与空气中的二氧化碳和水反应生成碳酸氢钠:Na2CO3+CO2+H2O=2NaHCO3.
某中学化学研究性学习小组对一瓶开启后久置的碳酸钠是否变质及变质程度进行研究.
【提出假设】 假设Ⅰ:完全变质;假设Ⅱ:没有变质;假设Ⅲ:________________.
【实验探究】 实验一:取少量样品于试管中,加水溶解后再加入少量CaCl2溶液,产生白色沉淀,说明假设________不成立.反应的化学方程式为________________________.
实验二:取少量样品于试管中,用导管连接后固定在铁架台上,导管的另一端插入澄清石灰水中.加热样品,有气体产生,澄清的石灰水变浑浊,说明假设________不成立.
【实验结论】 假设________成立,样品的成分是________.
【交流反思】 欲除去Na2CO3变质后产生的杂质,最合适的方法是________________________________.
碳酸氢钠是一种重要的盐类物质,在生活中用途广泛.小滨同学设计了实验,以探究碳酸氢钠的化学性质.
[探究实验1]碳酸氢钠溶液的酸碱性
[实验方案1]取少量该固体加入试管中,加适量水溶解,再滴入几滴酚酞溶液,振荡.
现象:溶液变成浅红色.由此得出结论________________________________________
________________________________________________________________________.
[探究实验2]能与酸反应
[实验方案2]取少量该固体加入试管中,滴加稀盐酸,现象为________________________________.
[探究实验3]碳酸氢钠的热稳定性
[实验方案3]用下图所示装置进行实验
现象:充分加热后,大试管口有水珠出现,管底有白色固体残留,小试管中澄清石灰水变浑浊.
结论:碳酸氢钠受热能生成二氧化碳、水和一种白色固体.
验证:(1)请你帮小滨设计实验,证明试管中留下的白色固体是Na2CO3,而不是NaOH(所选试剂不能用酸).
步骤:________________________________________________________________________.
现象:________________________________________________________________________.
(2)碳酸氢钠受热分解的化学方程式________.
[拓展应用]试说出碳酸氢钠在日常生活中的一种用途________________________________.
某化学兴趣小组的同学围绕“澄清石灰水与碳酸钠溶液的反应”展开了如下探究活动。
(1)该反应的化学方程式为_____________________________________.
(2)反应后溶液中的溶质是什么?同学们一致认为有以下三种情况:①氢氧化钠和氢氧化钙;②氢氧化钠和碳酸钠;③________________.
(3)小新取少量溶液于试管中,滴加过量稀盐酸,发现无气泡产生,说明情况________(填序号)是不可能的。
为了进一步确定溶液的成分,同学们设计了如下实验方案:
小红选择了另外一种不同类别的物质_________(填化学式),也得到了同样的结论。
在做盐和盐反应的分组实验时,第一组学生进行氯化钡与碳酸钠溶液的反应,第二组学生进行氯化钡和硫酸钠溶液的反应。
实验结束后,两组同学将全部的浊液集中倒进一个废液缸中,浊液中白色沉淀物质是______和______.
化学兴趣小组对浊液进行过滤,探究滤液的成分。
【提出问题】滤液里除了氯化钠外,还有什么物质?
【提出猜想】猜想①:__________;猜想②: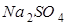 ;猜想③:
;猜想③: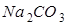 ;猜想④:
;猜想④: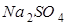 、
、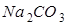
【实验探究】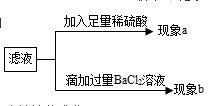
若现象a只有白色沉淀,则猜想________成立;
若现象a只有气泡产生,则猜想________可能成立;
若现象b产生白色沉淀,然后加稀硝酸沉淀部分溶解,并产生气泡,则猜想_______成立;若沉淀全部不溶解,则猜想________成立。