某化学兴趣小组的同学围绕“澄清石灰水与碳酸钠溶液的反应”展开了如下探究活动。
(1)该反应的化学方程式为_____________________________________.
(2)反应后溶液中的溶质是什么?同学们一致认为有以下三种情况:①氢氧化钠和氢氧化钙;②氢氧化钠和碳酸钠;③________________.
(3)小新取少量溶液于试管中,滴加过量稀盐酸,发现无气泡产生,说明情况________(填序号)是不可能的。
为了进一步确定溶液的成分,同学们设计了如下实验方案:
小红选择了另外一种不同类别的物质_________(填化学式),也得到了同样的结论。
课外化学兴趣小组的同学利用某化工厂的废碱液(主要成分为Na2CO3、还含有少量NaCl)和石灰乳(氢氧化钙的悬浊液)为原料制备烧碱,并对所得的烧碱粗产品的成分进行分析和测定。
【查阅资料】①碱石灰是CaO与NaOH的固体混合物,可吸收二氧化碳和水;
②CO2+Ba(OH)2 ═ BaCO3↓+H2O。
【粗产品制备】
(1)将废碱液加热蒸发浓缩,形成较浓的溶液,冷却后与石灰乳混合,发生反应的化学方程式为。
(2)将反应后的混合物过滤,得到的滤液进行蒸发结晶,制得NaOH粗产品。
【粗产品成分分析】
(1)取适量粗产品溶于水得澄清溶液,加入Ba(NO3)2溶液出现白色沉淀,由此该粗产品中一定不含有,理由是
(2)该小组同学通过对粗产品成分的实验分析,确定该粗产品中含有三种物质。
【含量测定】Na2CO3含量的测定:
该兴趣小组的同学设计了下图所示的实验装置。取20.0g粗产品,进行实验。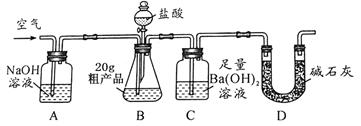
(1)实验过程中需持续缓缓通入空气,其目的是。
(2)下列各项措施中,不影响测定准确度的是______(填标号)。
a.在加入盐酸之前,应排净装置内的CO2气体
b.滴加盐酸不宜过快
c.在A-B之间增添盛有浓硫酸的洗气装置
d.取消上图中D装置
(3)实验中准确称取20.0g粗产品,进行测定,测得BaCO3质量为1.97g。则粗产品中碳酸钠的质量分数为。
(4)有人认为不必测定C中生成的BaCO3质量,只要测定装置C在吸收CO2前后的质量差,一样可以确定碳酸钙的质量分数.实验证明按此方法测定的结果明显偏高,原因是。
一次趣味化学活动中,王老师向同学们展示了一瓶标签受损的无色溶液,如下图所示。
要求同学们进行探究:
确认这瓶溶液到底是什么溶液?
提出猜想:王老师提示:这瓶无色溶液只能是以下四种溶液中的一种:
①硫酸镁溶液、 ②硫酸钠溶液、
③硫酸溶液、 ④硫酸铵溶液。
查阅资料:
A:常温下,相关物质的溶解度如下
| 物质 |
MgSO4 |
Na2SO4 |
(NH4)2SO4 |
H2SO4 |
| 溶解度 |
35.1g |
19.5g |
75.4g |
与水任意比互溶 |
B:(NH4)2SO4的水溶液显酸性
【实验探究】
(1)通过查阅资料,小明同学认为猜想(填序号)不成立,原因是。
(2)为确定其它几种猜想是否正确,小明同学继续进行探究:
| 实验步骤 |
实验现象 |
实验结论 |
| a取该溶液少许于试管中,向其中滴加几滴氢氧化钠溶液 |
溶液中有白色沉淀生成 |
猜想①成立 |
| b取该溶液少许于试管中,向其中滴加几滴紫色石蕊溶液 |
猜想③成立 |
小芳同学认为小明实验步骤b的结论不正确,她的理由是;
(3)请你设计实验方案,确认该溶液是硫酸铵溶液并完成实验报告:
| 实验操作 |
实验现象 |
实验结论 |
| 取该溶液少许于试管中,再往该溶液加入溶液,加热。 |
猜想④成立,该反应的化学方程式为 |
小明做盐酸和氢氧化钠溶液中和反应的实验时,没有加入指示剂,导致无法判断该中和反应进行的程度。请你和他一起探究所得溶液的酸碱性,并完成下列问题。
【提出猜想】所得溶液可能呈碱性,也可能呈。
【实验探究】
| 实验操作 |
实验现象 |
实验结论 |
| 用试管取该溶液1~2mL,滴入1~2滴无色酚酞试液,振荡 |
无色酚酞试液不变色 |
溶液呈。 |
【拓展分析】
若溶液呈碱性,他向溶液中逐渐加入硫酸铜溶液,直到不再产生沉淀为止,然后过滤,留在滤纸上的物质是(写化学式,下同),滤液中一定含有的溶质是。
某校兴趣小组进行常见酸、碱、盐的性质实验时,发现实验台上摆放的药品中(如下图),有一装溶液的试剂瓶未盖瓶盖且标签破损,于是决定对这瓶溶液进行实验探究:
【提出问题】这瓶溶液是什么溶液?
【获得信息】酸、碱、盐的性质实验中用到含有钠元素的物质是氯化钠、氢氧化钠、碳酸钠
【提出猜想】这瓶溶液是:猜想一:氯化钠溶液;猜想二:氢氧化钠溶液;猜想三:碳酸钠溶液。
【实验推断】(1)小华取样滴加无酚酞试液,溶液呈红色,得出结论:该溶液不可能是__________溶液。
(2)小刚另取样滴加稀盐酸有__________产生,小刚得出结论:该溶液是碳酸钠溶液。
(3)小军认为小刚的结论不完全正确,理由是在空气中变质的氢氧化钠与盐酸反应也能产生气泡。
小组同学讨论后一致认为还需要进行如下实验:
【继续探究】另取样加入过量的CaCl2溶液,观察到有______产生,设计这一步骤的目的是________;静置后,取上层清液,滴入酚酞试液,溶液呈红色。
【实验结论】这瓶溶液是__________。
【探究启示】实验取完药品后应__________。
实验室处理一批过期的化学药品,兴趣小组同学决定对一癣已经结块的氢氧化钠样品展开探究,请你参与。
[探究活动一]证明变质的样品仍然有氢氧化钠存在
资料摘要:碳酸钠的水溶液呈碱性,氯化钠、氯化钙的水溶液呈中性。
(1)氢氧化钠暴露在空气中发生变质反应的化学方程式为。
同学们按照如下所示的步骤进行实验:
(2)步骤②中加入过量的氯化钙溶液的目的是;固体A必定含有的物质是(写化学式)。
(3)“后续实验”验证氢氧化钠的存在,请你简述实验步骤和产生的现象:。
[探究活动二]测定样品中碳酸钠的质量分数
取5.3g样品与足量的稀硫酸反应,测量生成二氧化碳的体积,从而计算出碳酸钠的质量分数。实验装置如图(不考虑其他因素的影响,装置的气密性良好):
(4)倾斜锥形瓶使样品与稀硫酸充分接触。写出甲装置中发生反应的一个化学方程式:。
(5)量气管中水面上要加一层植物油(二氧化碳不溶于该油层),目的是。
(6)实验测得的部分数据如下表所示:
| 反应前 |
反应后 |
|
| 量气管内液面对应的刻度 |
42mL |
262mL |
根据表中的实验数据计算,反应生成的二氧化碳体积为mL,已知在实验条件下,二氧化碳的密度为2g·L-1,则生成二氧化碳的质量为g。
(7)通过计算,样品中碳酸钠的质量分数为。