实验室处理一批过期的化学药品,兴趣小组同学决定对一癣已经结块的氢氧化钠样品展开探究,请你参与。
[探究活动一]证明变质的样品仍然有氢氧化钠存在
资料摘要:碳酸钠的水溶液呈碱性,氯化钠、氯化钙的水溶液呈中性。
(1)氢氧化钠暴露在空气中发生变质反应的化学方程式为 。
同学们按照如下所示的步骤进行实验:
(2)步骤②中加入过量的氯化钙溶液的目的是 ;固体A必定含有的物质是 (写化学式)。
(3)“后续实验”验证氢氧化钠的存在,请你简述实验步骤和产生的现象: 。
[探究活动二]测定样品中碳酸钠的质量分数
取5.3g样品与足量的稀硫酸反应,测量生成二氧化碳的体积,从而计算出碳酸钠的质量分数。实验装置如图(不考虑其他因素的影响,装置的气密性良好):
(4)倾斜锥形瓶使样品与稀硫酸充分接触。写出甲装置中发生反应的一个化学方程式: 。
(5)量气管中水面上要加一层植物油(二氧化碳不溶于该油层),目的是 。
(6)实验测得的部分数据如下表所示:
| |
反应前 |
反应后 |
| 量气管内液面对应的刻度 |
42mL |
262mL |
根据表中的实验数据计算,反应生成的二氧化碳体积为 mL,已知在实验条件下,二氧化碳的密度为2g·L-1,则生成二氧化碳的质量为 g。
(7)通过计算,样品中碳酸钠的质量分数为 。
小明对铁的锈蚀进行如下探究。室温时,将包有样品的滤纸包用大头针固定在橡胶塞上,迅速塞紧瓶塞.装置如图5 , 观察到量筒内水沿导管慢慢进入净容积为146 mL的广口瓶。当温度恢复至室温,且量筒内水面高度不再变化时读数。记录量筒起始和最终的读数以及所需时间如下表。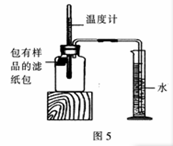
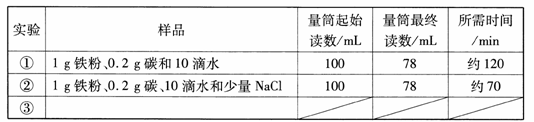
(1)实验①和②说明NaCl可以(填“加快”或“减慢”)铁锈蚀的速率。
(2)实验开始后,广口瓶内温度有所上升,说明铁的锈蚀过程是(填“放热”或“吸热”)过程。
(3)实验后滤纸包中生成的新物质主要成分的化学式:。
(4)实验①和③是探究碳对铁锈蚀速率的影响,填写实验③的样品组成:。
(5)小明认为该装置还可用于测量空气中氧气的含量,根据上述数据计算氧气的体积含量是(得数保留小数点后3位)。
(6)为进一步验证(5)小题的实验结果,现仅提供:量筒、大烧杯、玻璃棒、水、滤纸包(内含铁粉、碳、水和NaCl),请你帮助小明再设计一个测量空气中氧气体积含量的实验方案(可画简图表示)。
多角度认识物质,能帮助我们更全面了解物质世界。以碳的氧化物为例,回答下列问题:
(1)认识物质的组成和结构
二氧化碳、一氧化碳组成的相同点:;
两种物质分子构成的不同点:。
(2)认识物质的性质
①将蘸有酒精的棉芯点燃后放入烧杯,向烧杯中倾倒二氧化碳气体,观察到烧杯中的棉芯自下而上熄灭(如图1所示),说明二氧化碳具有的性质是;若使棉芯下半段立即恢复燃烧,操作方法是。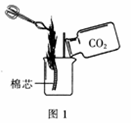
②将燃着的镁条伸入装有二氧化碳气体的烧杯中,镁条继续燃烧,说明二氧化碳还具有的性质是。
(3)认识物质的制法
某同学用软塑料瓶自制气体发生装置,通过捏放瓶身可随时控制反应发生和停止(如图2所示)。若利用该装置制取二氧化碳,反应的化学方程式;若实验利用该装置制取氧气无纺布包内药品为(写化学式)
(4)认识物质的用途
①扬其利抑其弊。减少二氧化碳排放以控制温室效应,合理使用二氧化碳为人类造福。请举二氧化碳用途一例:。
②控制条件获取所需物质。反应物相同,条件不同,产物不同。请举一例:。
科学探究是奇妙的过程,再一次实验中小文不小心把硫酸铁溶液滴加到了盛有5%H 2 O 2 的溶液的试管中,立即有大量的气泡产生.硫酸铁溶液中含有三种粒子(H2O、SO42-、Fe3+),小文想知道硫酸铁溶液中的哪种粒子能使双氧水分解的速率加快.请你和小文一起通过下图所示的三个实验完成这次探究活动,并填写空白.
(1)你认为最不可能的是哪一种粒子________,理由是.
(2)检验实验产生的气体是否是氧气的方法是.
(3)在实验②中加入稀硫酸后,无明显变化,说明________不起催化作用;
(4)小明如果要确定硫酸铁是催化剂,还须通过实验确认它在化学反应前后______________.
(5)经证明硫酸铁是过氧化氢分解的催化剂,写出硫酸铁催化过氧化氢分解的化学方程式____________.
注意:若答对(6)小题奖励4分,但化学试卷总分不超过60分。
(6)小华通过实验发现,硫酸铁溶液的浓度也会影响过氧化氢分解的速率,常温下,他在a,b,c,三个试管中分别加入等量5%过氧化氢的溶液,在其他条件相同时,各滴2滴5%、10%、20%的硫酸铁溶液。根据实验数据绘制了产生的氧气体积和时间变化的曲线如图。请你观察右图回答问题。
①写出两条规律性结论:____________。
②若实验中所得的曲线如图中虚线所示,请推测其中可能的原因____________。
食品包装袋中常用脱氧剂。某化学兴趣小组将脱氧剂封口打开,将其倒在滤纸上,
观察到脱氧剂大部分为黑色粉末,其中还夹杂着少量红色粉末。
【提出问题】该脱氧剂中的黑色、红色粉末各是什么?
【提出猜想】黑色粉末可能含炭粉、铁粉、氧化铜中的一种或几种。红色粉末可能含有氧
化铁、铜粉中的一种或几种。
【进行实验】
| 实验编号 |
实验操作 |
实验现象 |
| ① |
取脱氧剂粉末加入足量稀硫酸 |
粉末几乎全部溶解,只有少量黑色粉末未溶解,有气泡产生,溶液变成黄色 |
| ② |
去实验①的残渣灼烧,将内壁有澄清石灰水的小烧杯罩在上方 |
澄清石灰水变浑浊 |
【得出结论】由实验①②可知,脱氧剂中黑色粉末肯定含。
脱氧剂中的红色粉末肯定不含,肯定含,写出相应的化学方程式。
【拓展延伸】小明认为铁生锈时会消耗氧气,因此可用此脱氧剂(实验室可滴几滴水)测定空气中氧气的含量,装置如图所示。集气瓶的实际容积是150mL,量筒内盛100mL的水。当量筒内水面不再变化,且温度恢复至室温时,读出水面在73mL刻度处。由上述实验数据可以算出,空气中氧气的体积分数是。本实验的测量结果与理论值不一致,原因可是。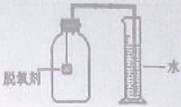
粗盐中含有泥沙等难溶性杂质和氯化镁、氯化钙等可溶性杂质,某学习小组做粗盐的提纯实验。
【提出问题】如何才能将粗盐中的杂质除去,获得精盐?
【实验方案】该小组按以下流程进行实验。
【问题讨论】
(1)实验步骤②③④都需要进行操作,该操作中玻璃棒的作用是。
(2)沉淀X是,沉淀Y是。
(3)有同学认为该实验方案不完善,请你说明原因并补充完善:。
(4)将实验所得的精盐在烧杯中配制成100g 8﹪的氯化钠溶液。经检测,所配溶液溶质质量分数偏小,其可能原因有(填序号)。
①精盐称量时,仅在左盘垫上了称量纸,而右盘没有垫上称量纸;
②溶解时所用烧杯不干燥;
③所得精盐未完全干燥。
(5)工业上用电解饱和食盐水的方法可制取氢氧化钠,同时还生成两种气体单质。写出此反应的化学方程式。