二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。回答下列问题:
(1)二氧化碳加氢制甲醇的总反应可表示为:
该反应一般认为通过如下步骤来实现:
①
②
总反应的 _______ ;若反应①为慢反应,下列示意图中能体现上述反应能量变化的是________(填标号),判断的理由是_______。

(2)合成总反应在起始物 时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为 ,在 ℃下的 、在 下的 如图所示。
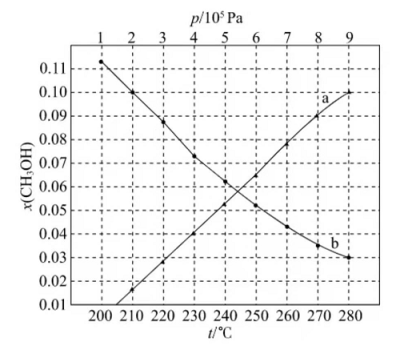
①用各物质的平衡分压表示总反应的平衡常数,表达式 ________;
②图中对应等压过程的曲线是________,判断的理由是_________;
③当 时, 的平衡转化率 __________,反应条件可能为________或_______。
磁选后的炼铁高钛炉渣,主要成分有 、 、 、 、 以及少量的 。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。

该工艺条件下,有关金属离子开始沉淀和沉淀完全的pH见下表
|
金属离子 |
|
|
|
|
|
开始沉淀的pH |
2.2 |
3.5 |
9.5 |
12.4 |
|
沉淀完全 的pH |
3.2 |
4.7 |
11.1 |
13.8 |
回答下列问题:
(1)"焙烧"中, 、 几乎不发生反应, 、 、 、 转化为相应的硫酸盐。写出 转化为 的化学方程式 。
(2)"水浸"后"滤液"的 约为2.0,在"分步沉淀"时用氨水逐步调节 至11.6,依次析出的金属离子是 。
(3)"母液①"中 浓度为 。
(4)"水浸渣"在 "酸溶",最适合的酸是 。"酸溶渣"的成分是 、 。
(5)"酸溶"后,将溶液适当稀释并加热, 水解析出 沉淀,该反应的离子方程式是 。
(6)将"母液①"和"母液②"混合,吸收尾气,经处理得 ,循环利用。
近年来,以大豆素(化合物C)为主要成分的大豆异黄酮及其衍生物,因其具有优良的生理活性而备受关注.大豆素的合成及其衍生化的一种工艺路线如下:

回答下列问题:
(1)A的化学名称为_______。
(2) 反应生成E至少需要______ 氢气。
(3)写出E中任意两种含氧官能团的名称_______。
(4)由E生成F的化学方程式为_________。
(5)由G生成H分两步进行:反应1)是在酸催化下水与环氧化合物的加成反应,则反应2)的反应类型为________。
(6)化合物B的同分异构体中能同时满足下列条件的有_______(填标号)。
a.含苯环的醛、酮
b.不含过氧键( )
c.核磁共振氢谱显示四组峰,且峰面积比为3∶2∶2∶1
| A. |
2个 |
B. |
3个 |
C. |
4个 |
D. |
5个 |
(7)根据上述路线中的相关知识,以丙烯为主要原料用不超过三步的反应设计合成:

我国科学家研发的全球首套千吨级太阳能燃料合成项目被形象地称为"液态阳光"计划。该项目通过太阳能发电电解水制氢,再采用高选择性催化剂将二氧化碳加氢合成甲醇。回答下列问题:
(1)太阳能电池板主要材料为单晶硅或多晶硅。Si的价电子层的电子排布式为______;单晶硅的晶体类型为_______。SiCl 4是生产高纯硅的前驱体,其中Si采取的杂化类型为______。SiCl 4可发生水解反应,机理如下:

含s、p、d轨道的杂化类型有:①dsp 2、②sp 3d、③sp 3d 2,中间体SiCl 4(H 2O)中Si采取的杂化类型为_______ (填标号)。
(2)CO 2分子中存在________个σ键和________个π键。
(3)甲醇的沸点(64.7℃)介于水(100℃)和甲硫醇(CH 3SH,7.6℃)之间,其原因是_____________。
(4)我国科学家发明了高选择性的二氧化碳加氢合成甲醇的催化剂,其组成为ZnO/ZrO 2固溶体。四方ZrO 2晶胞如图所示。Zr 4+离子在晶胞中的配位数是____________,晶胞参数为 apm、 apm、 cpm,该晶体密度为____________g·cm -3(写出表达式)。在ZrO 2中掺杂少量ZrO后形成的催化剂,化学式可表示为Zn xZr 1- xO y,则 y=____________(用 x表达)。

二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。回答下列问题:
(1)二氧化碳加氢制甲醇的总反应可表示为:
该反应一般认为通过如下步骤来实现:
①
②
总反应的 _______ ;若反应①为慢反应,下列示意图中能体现上述反应能量变化的是________(填标号),判断的理由是_______。

(2)合成总反应在起始物 时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为 ,在 ℃下的 、在 下的 如图所示。

①用各物质的平衡分压表示总反应的平衡常数,表达式 ________;
②图中对应等压过程的曲线是________,判断的理由是_________;
③当 时, 的平衡转化率 __________,反应条件可能为________或_______。
胆矾( )易溶于水,难溶于乙醇。某小组用工业废铜焙烧得到的 (杂质为氧化铁及泥沙)为原料与稀硫酸反应制备胆矾,并测定其结晶水的含量。回答下列问题:
(1)制备胆矾时,用到的实验仪器除量筒、酒精灯、玻璃棒、漏斗外,还必须使用的仪器有________(填标号)。
| A. |
烧杯 |
B. |
容量瓶 |
C. |
蒸发皿 |
D. |
移液管 |
(2)将 加入到适量的稀硫酸中,加热,其主要反应的化学方程式为___________,与直接用废铜和浓硫酸反应相比,该方法的优点是_________。
(3)待 完全反应后停止加热,边搅拌边加入适量 ,冷却后用 调 为3.5~4,再煮沸 ,冷却后过滤。滤液经如下实验操作:加热蒸发、冷却结晶、________、乙醇洗涤、________,得到胆矾。其中,控制溶液 为3.5~4的目的是_________,煮沸 的作用是_________。
(4)结晶水测定:称量干燥坩埚的质量为 ,加入胆矾后总质量为 ,将坩埚加热至胆矾全部变为白色,置于干燥器中冷至室温后称量,重复上述操作,最终总质量恒定为 。根据实验数据,胆矾分子中结晶水的个数为_________(写表达式)。
(5)下列操作中,会导致结晶水数目测定值偏高的是________(填标号)。
| A. |
①胆矾未充分干燥 |
| B. |
②坩埚未置于干燥器中冷却 |
| C. |
③加热时有少胆矾迸溅出来 |