过氧化钙微溶于水,溶于酸,可用作分析试剂、医用防腐剂、消毒剂.以下是一种制备过氧化钙的实验方法.回答下列问题:
(一)碳酸钙的制备

(1)步骤①加入氨水的目的是________.小火煮沸的作用是使沉淀颗粒长大,有利于________.
(2)如图是某学生的过滤操作示意图,其操作不规范的是________(填标号).

| A. | 漏斗末端颈尖未紧靠烧杯壁 |
| B. | 玻璃棒用作引流 |
| C. | 将滤纸湿润,使其紧贴漏斗壁 |
| D. | 滤纸边缘高出漏斗 |
| E. | 用玻璃棒在漏斗中轻轻搅动以加过过滤速度 |
(3)(二)过氧化钙的制备
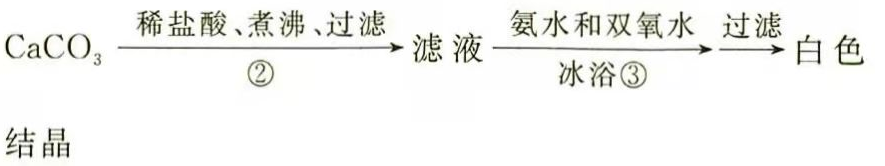
步骤②的具体操作为逐滴加入稀盐酸,至溶液中尚存有少量固体,此时溶液呈________性(填"酸"、"碱"或"中").将溶液煮沸,趁热过滤,将溶液煮沸的作用是________.
(4)步骤③中反应的化学方程式为________,该反应需要在冰浴下进行,原因是________.
(5)将过滤得到的白色结晶依次使用蒸馏水、乙醇洗涤,使用乙醇洗涤的目的是________.
(6)制备过氧化钙的另一种方法是:将石灰石煅烧后,直接加入双氧水反应,过滤后可得到过氧化钙产品.该工艺方法的优点是________,产品的缺点是________.
硫酸工业尾气中二氧化硫含量超过0.05%(体积分数)时需经处理后才能排放。某校兴趣小组欲测定硫酸工业尾气中二氧化硫含量,采用以下方案:
甲方案:如下图所示,图中气体流量计B用于准确测量通过尾气的体积。将尾气通入一定体积已知浓度的碘水中测定二氧化硫的含量。当洗气瓶C中溶液蓝色消失时,立即关闭活塞A,根据碘水用量可计算SO2的量,与气体流量计数据之比即可判断SO2是否超标。
(1)已知二氧化硫与碘水的反应为:SO2+ I2+H2O==H2SO4+HI,配平该反应并指出还原剂。
I2+H2O==H2SO4+HI,配平该反应并指出还原剂。
(2)洗气瓶C中导管末端连接一个多孔球泡D,可以提高实验准确度,其理由是:。
(3)洗气瓶C溶液蓝色消失后,没有及时关闭活塞A,测得的SO2含量
(填“偏高”、“偏低”或“无影响”)。
乙方案:尾气被过氧化氢氧化后与氢氧化钡反应,实验步骤如以下流程图所示:
(4)写出步骤①中反应的化学方程式。
(5)写出步骤②中反应的化学方程式 。
。
(6)通过的尾气体积为VL(已换算成标准状况)时,该尾气中二氧化硫含量(体积分数)为(用含有V、m的代数式表示)。
(7)若将乙方案中步骤①省略,直接将尾气通入过量Ba(OH)2溶液,其余步骤与方案乙相同,你认为这样处理是否合理,说明理由:。
化学能在一定的条件下可以转化为电能。
(一)现有如下两个反应:
① 2FeCl3 + Cu = 2FeCl2 + CuCl2
② Na2CO3 + 2HCl =" 2NaCl" + H2O + CO2↑
(1)根据两个反应的本质判断,您认为可以设计成原电池的是(填反应序号)。
(二)请根据Zn + CuSO4 = ZnSO4 + Cu反应,选择适宜的材料和试剂设计一个 原电池。
原电池。
(2)画出原电池装置图,并在图中标注出电极和电解质溶液的名称。
(3)写出该原电池电极反应式:正极:;负极:。
实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH4++6HCHO=3H++6H2O+(CH2)6N4H+[滴定时,1 mol (CH2)6N4H+与 l mol H+相当],然后用NaOH标准溶液滴定反应生成的酸,某兴趣小组用甲醛法进行了如下实验:
步骤Ⅰ称取1.500 g样品,加水溶解,配成250 mL溶液。
步骤Ⅱ用酸式滴定管量取25.00 mL样品溶液于 250 mL锥形瓶中,加入10mL 20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞试液。用0.1010 mol·L-1的NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
250 mL锥形瓶中,加入10mL 20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞试液。用0.1010 mol·L-1的NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
⑴根据实验步骤填空:
①步骤Ⅰ中用到的主要玻璃仪器有;
②步骤Ⅱ中酸式滴定管用蒸馏水洗涤后,直接加入样品溶液进行量取,则测得样品中氮质量分数(填“偏高”、“偏低”或“无影响”,下同)。锥形瓶用蒸馏水洗涤后,水未倒尽,则对滴定时用去NaOH标准溶液的体积。滴定时对NaOH标准溶液体积,读取初读数时仰视,读取终读数时姿势正确,则测得样品中氮质量分数。
③滴定时边滴边摇动锥形瓶,眼睛应观察
A.滴定管内液面的变化
B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由色变成色。
⑵滴定结果如表所示:
| 滴定次数 |
待测溶液体积/ml |
标准NaOH溶液体积读数(ml) |
|
| 滴定前/ml |
滴定后/ml |
||
| 1 |
25.00 |
1.02 |
21.03 |
| 2 |
25.00 |
2.00 |
21.99 |
| 3 |
25.00 |
2.30 |
22.30 |
则消耗NaOH标准溶液的体积平均为,该样品中氮的质量分数为。
以电解食盐水为基础制取氯气等产品的工业称为“氯碱工业”,它是目前化学工业的重要支柱之一。
(1)电解饱和食盐水的化学方程式为。
(2)常温下,某化学兴趣小组在实验室中,用石墨电极以右图装置进行电解某浓度氯化钠溶液的实验,电解一段时间后,收集到标准状况下氢气2. 24 L。(设电解前后溶液的体积均为1 L,不考虑水的蒸发或气体的溶解)(已知:lg5==0.70)
24 L。(设电解前后溶液的体积均为1 L,不考虑水的蒸发或气体的溶解)(已知:lg5==0.70)
①理论上,电解后溶液的pH=。
②若实际测得反应后溶液的pH=13.00,则造成这种误差的原因可能是氯气和氢氧化钠溶液反应,写出该反应的离子方程式。
(1)在实验室制取蒸馏水的装置中,温度计的水银球应位于;烧瓶中应放几粒沸石(或碎瓷片),其作用是;冷凝管中冷凝水的流向应当是(流向用上口、下口、谁为进水口,谁为出水口表示)。
(2)实验室欲配制0.5 mol·L-1的NaOH溶液500 mL,有以下仪器:
①烧杯 ②100 mL量筒③1000 mL 容量瓶④500 mL 容量瓶⑤玻璃棒 ⑥托盘天平(带砝码)
a:配制时,必须使用的仪器有 (填代号),还缺少的仪器是 ,该实验中两次用到玻璃棒,其作用分别是 、 。
b:配制时,一般可分为以下几个步骤:①称量 ②计算 ③溶解 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却,其正确的操作顺序是。
c:在配制NaOH溶液时,下列操作会导致结果偏低的是
(1)用拖盘天平称量时砝码放在左盘(2)溶解NaOH固体后没有冷却至室温就向容量瓶转移溶液
(3)将烧杯中的溶液转移到容量瓶时不慎洒到容量瓶外(4)定容时俯视刻度线(5)定容时仰视刻度线
(6)干净的容量瓶未经干燥就用于配制溶液