乙酰水杨酸(阿司匹林)是目前常用药物之一。实验室通过水杨酸进行乙酰化制备阿司匹林的一种方法如下:

水杨酸 |
醋酸酐 |
乙酰水杨酸 |
|
熔点/℃ |
157~159 |
-72~-74 |
135~138 |
相对密度/(g·cm ﹣ 3) |
1.44 |
1.10 |
1.35 |
相对分子质量 |
138 |
102 |
180 |
实验过程:在 锥形瓶中加入水杨酸 及醋酸酐 ,充分摇动使固体完全溶解。缓慢滴加 浓硫酸后加热,维持瓶内温度在 左右,充分反应。稍冷后进行如下操作.
①在不断搅拌下将反应后的混合物倒入100 mL冷水中,析出固体,过滤。
②所得结晶粗品加入50 mL饱和碳酸氢钠溶液,溶解、过滤。
③滤液用浓盐酸酸化后冷却、过滤得固体。
④固体经纯化得白色的乙酰水杨酸晶体5.4 g。
回答下列问题:
(1)该合成反应中应采用__________加热。(填标号)
| A. |
热水浴 |
| B. |
酒精灯 |
| C. |
煤气灯 |
| D. |
电炉 |
(2)下列玻璃仪器中,①中需使用的有________(填标号),不需使用的________(填名称)。

(3)①中需使用冷水,目的是________。
(4)②中饱和碳酸氢钠的作用是________,以便过滤除去难溶杂质。
(5)④采用的纯化方法为________。
(6)本实验的产率是________%。
实验室制乙烯时因使用的试剂浓硫酸既有强脱水性,又有强氧化性,在加热条件下,乙醇很有可能与浓硫酸参加反应,生成二氧化碳、二氧化硫、水蒸气、炭。该副反应的化学方程式是:_________________________________有同学设计了如下三个方案检验,检验二氧化碳、二氧化硫、水蒸气这三种物质的存在,请评价是否可行?
方案一:
方案二:
方案三:
你认为合理的设计方案应怎样?
某同学用下图所示装置制取乙烯,请回答: 
(1)在装置①~③中,有明显错误的一个装置是_____(填序号)。
(2)实验室制取乙烯的化学方程式为。
(3)若装置②中所盛试剂为氢氧化钠溶液,则其作用为。
(4)若装置③中的试剂为溴的四氯化碳溶液,则所发生的反应类型为________反应。
(5)实验前往往在烧瓶中加入一些碎瓷片,目的是:__________________________。
实验室用固体NaOH配制0.5 mol/L的NaOH溶液500 mL,有以下仪器和用品有:①烧杯 ②100 mL量筒 ③容量瓶 ④药匙 ⑤玻璃棒 ⑥托盘天平(带砝码)
(1)配制时,没有使用的仪器和用品有____________(填序号),还缺少的仪器是。
(2)在配制的转移过程中某学生进行如右图操作,请指出其中的错误:、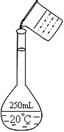
(3)下列操作会使配制的溶液浓度偏低的是(填字母)
A. 没有将洗涤液转移到容量瓶B.转移过程中有少量溶液溅出
C. 容量瓶洗净后未干燥 D.定容时俯视刻度线
(4)在容量瓶使用方法中,下列操作不正确的是(填序号)
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用碱液润洗
C.将氢氧化钠固体放在天平托盘的滤纸上,准确称量并放入烧杯中溶解后,立即注入容量瓶中
D.定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀
(5) 实验中还需要2mol/L的NaOH溶液950mL,配制时应选用的容量瓶的规格和称取NaOH的质量分别是(填序号)
A.1000mL,80gB.950mL,76g
C.任意规格,72gD.500mL,42g
某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。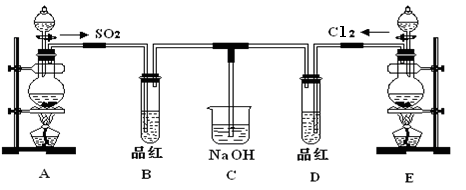
(1)实验室用装置E制备Cl2,其反应的化学化学方程式为:MnO2+4HCl(浓) MnCl2+Cl2 +2H2O请指出该反应中的液体反应物在反应中所表现出的化学性质:
MnCl2+Cl2 +2H2O请指出该反应中的液体反应物在反应中所表现出的化学性质:
____________________________________________________________________;
(2)①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是:
B:________________________________,D:_________________________。
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为
B:________________________________,D:____________________________。
(3)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强,他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象那样。请你分析该现象的原因(用化学方程式表示)__________________________________
实验室模拟合成氨和氨催化氧化的流程如下: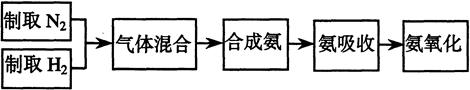
已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气。
(1)从图中选择制取气体的合适装置: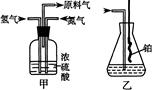
氮气、氢气
(2)氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还有、
(3)氨合成器出来经冷却的气体连续通人乙装置的水中吸收氨,(“会”或“不会”)发生倒吸,原因是:。
(4)写出乙装置中氨催化氧化的化学方程式:
(5)反应结束后锥形瓶内的溶液中含有H+、OH-、、离子。