为验证Cl2、Br2的氧化性强弱,设计了如下实验:(可供选择的试剂有:氯水、溴水、NaCl溶液、NaBr溶液、酒精、四氯化碳)实验步骤如下图,填写图中的空白。
(1)2 mL 试剂 ;加入少量 试剂;再加入
试剂; 现象: 。
(2)可以证明Cl2的氧化性____________(填“强于”或“弱于”)Br2的氧化性;氯元素的非金属性 ____________(填“强于”或“弱于”)_溴元素的非金属性。
( 3 )此反应的离子方程式为:________________________________________。
(4)某溶液中Cl-、Br-、I-的物质的量之比为4∶1∶4,要使溶液中的Cl-、Br-、I-的物质的量之比变为7∶1∶1,则通入Cl2的物质的量与原溶液中I-的物质的量之比为______。
(14分)某研究性学习小组研究HNO3的氧化性,设计了如下实验:
在盛有新制FeSO4溶液的试管中滴入2滴KSCN溶液,观察现象,然后再滴入几滴浓HNO3,溶液的颜色变红,但是将红色溶液放置一会儿则发现溶液由红色快速变为蓝色,并产生红棕色气体,这一奇特现象激起了同学的好奇心与求知欲望,对此现象设计了探究性实验。
(1)甲同学认为是溶液中的Fe2+的干扰造成的,大家经过理性分析,认为可以排除Fe2+的干扰,理由是______________________________________________。
(2)乙同学认为红色消失,说明Fe(SCN)3被破坏,红棕色NO2说明了某些离子与HNO3发生了氧化还原,推测可能是KSCN与HNO3作用。KSCN溶液是一种无色液体,根据C、S、N的原子结构和共价键的相关知识推测SCN-中碳原子的杂化轨道类型是_______杂化。
(3)根据乙同学的观点,设计了实验方案1,往浓HNO3中逐滴加入KSCN溶液,实验开始时无明显现象,一段时间后溶液慢慢变红色至深红色,突然剧烈反应产生大量气泡,放出红棕色气体,而溶液红色消失变为浅绿色,溶液温度升高;继续滴入KSCN,溶液变为浅蓝色,最后变成无色。将产生的气体通入过量的Ba(OH)2溶液,产生浑浊,并剩余一种非极性气体;向反应后的溶液中加入BaCl2溶液产生白色沉淀,写出向浓HNO3中滴入KSCN的离子方程式______________________________。
(4)丙同学认为SCN-的性质还可进一步探究,设计了方案2,向Fe(SCN)3中分别滴加过量的氯水、溴水,溶液的红色均消失变为黄色,而加入碘水时溶液的颜色基本不变。丙同学的设计意图是____________。
(5)通过本次探究,可以得出以下结论:
a、用SCN-间接检验Fe2+时应注意__________;
b、与SCN-反应使溶液变红的______是Fe3+。
某研究性学习小组将一定浓度的Na2CO3溶液滴入MgSO4溶液中得到白色沉淀。甲同学认为两者反应只生成MgCO3一种沉淀;乙同学认为这两者相互促进水解,只生成Mg(OH)2一种沉淀;丙同学认为生成MgCO3和Mg(OH)2两种沉淀。(查阅资料知:MgCO3和Mg(OH)2均不带结晶水)
(1)按照乙同学的理解Na2CO3溶液和MgSO4溶液反应的化学反应方程式为_______;
在探究沉淀物成分前,须将沉淀从溶液中分离并净化。具体操作为①过滤②洗涤③干燥。
(2)请用下图所示装置,选择合适的实验装置和必要的试剂,证明沉淀物中只有碳酸镁。
各装置连接顺序为__________________(用装置编号表示);
②装置C中装有试剂的名称是______________;
③能证明生成物中只有MgCO3的实验现象是_______。
(3)若Mg(OH)2和MgCO3两者都有,可通过下列所示装置的连接,进行定量分析来测定其组成。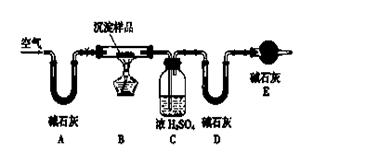
实验结束时通入过量的空气的作用________________。
A装置和E装置的共同作用是__________________________。
实验过程中测定的数据有:W1:样品的质量,W2:反应后装置B中残渣的质量,W3:反应生成水的质量,W4:反应生成二氧化碳的质量,为了测定其组成,至少需要其中个数据,请将可能的组合填入下表中(每个空格中填一种组合,至少填5个)。
【化学—选修2化学与技术】(15分)
氯化亚铜(CuCl)是白色粉末,微溶于水,不溶于乙醇,在空气中会被迅速氧化成绿色碱式盐。从酸性电镀废液(主要含Cu2+、Fe3+)中制备氯化亚铜的工艺流程图如下:
金属离子含量与混合液pH、CuCl产率与混合液pH的关系图如图。
【已知:金属离子浓度为1 mol·L-1时,Fe(OH)3开始沉淀和沉淀完全的pH分别为1.4和3.0,Cu(OH)2开始沉淀和沉淀完全的pH分别为4.2和6.7】
请回答下列问题:
(1)酸浸时发生反应的离子方程式是________;析出CuCl晶体时的最佳pH在_______左右。
(2)铁粉、氯化钠、硫酸铜在溶液中反应生成CuCl的离子反应方程式为________________。
(3)析出的CuCl晶体要立即用无水乙醇洗涤,在真空干燥机内于70℃干燥2 h、冷却密封包装。70℃真空干燥、密封包装的目的是_____________________________________。
(4)产品滤出时所得滤液的主要分成是________,若想从滤液中获取FeSO4·7H2O晶体,还需要知道的是__________________。
(5)若将铁粉换成亚硫酸钠也可得到氯化亚铜,试写出该反应的化学方程式:______________。为提高CuCl的产率,常在该反应体系中加入稀碱溶液,调节pH至3.5。这样做的目的是_____________。
(14分)过碳酸钠(2Na2CO3·3H2O2)是一种集洗涤、漂白、杀菌于一体的氧系漂白剂。某兴趣小组制备过碳酸钠的实验方案和装置示意图如下: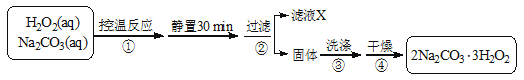
已知:主反应:2Na2CO3 (aq) + 3H2O2 (aq)  2Na2CO3·3H2O2 (s) ΔH < 0
2Na2CO3·3H2O2 (s) ΔH < 0
副反应:2H2O2 = 2H2O + O2↑
50℃时2Na2CO3·3H2O2 (s) 开始分解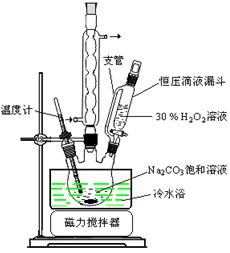
请回答下列问题:
(1)步骤①的关键是控制温度,原因是, 其措施有_______、_________和_________。
(2)在滤液X中加入适量NaCl固体可析出过碳酸钠,原因是_________________。
(3)步骤③中选用无水乙醇洗涤产品的目的是。
(4)下列物质中,会引起过碳酸钠失效的有。
| A.NaHCO3 | B.MnO2 | C.Na2SiO3 | D.Na2SO3 |
(5)过碳酸钠产品中往往含有少量碳酸钠,可用重量法测定过碳酸钠的质量分数;其操作步骤:取样品溶解→加入BaCl2溶液→过滤→洗涤→干燥→称量。需要直接测定的物理量有:样品的质量m1g、沉淀的质量m2g(用字母表示并注明其含义)。产品中过碳酸钠质量分数的表达式为:。
二氧化氯(ClO2)为一种黄绿色气体,是一种高效、广谱、安全的杀菌、消毒剂。制备ClO2的方法有多种。
(1)纤维素还原法制ClO2。其原理是:纤维素水解得到的最终产物A与NaClO3反应生成ClO2。完成反应的化学方程式:其流程如下:□(A)+□NaClO3+□H2SO4=□ClO2↑+□CO2↑+□H2O+□______
(2)电解食盐水制取ClO2 ,其流程如下:
①粗盐中含有Ca2+、Mg2+、SO42-等杂质。除杂操作时,往粗盐水中加入试剂的顺序依次为__________(填化学式),充分反应后将沉淀一并滤去,再加入盐酸。
②食盐水在特定条件下电解得到的氯酸钠(NaClO3)与盐酸在发生器中反应生成ClO2 ,写出发生器中生成ClO2的化学方程式____________________。
③上述流程中,可循环利用的物质有__________;按照绿色化学原则,电解槽阴极产生的气体与方框中物质的物质的量之比为________时,原子的利用率为100%。
(3)实验室以NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2的流程下如下:
已知:(I)A气体在标准状况下的密度为0.089g/L;
(Ⅱ)气体B能使湿润的红色石蕊试纸变蓝。
①电解时,发生反应的化学方程式为。
②NCl3与NaClO2(亚氯酸钠)按物质的量之比为1∶6混合,在溶液中恰好反应生成ClO2,该反应的离子方程式为。