味精是烹制菜肴时常用的调味品,其主要成分是谷氨酸钠(化学式为C5H8NO4Na)。谷氨酸钠有鲜味,易溶于水。某品牌味精包装上标注:“谷氨酸钠含量≥80%,NaCl含量≤20%”。某学校化学科研小组现对此味精中NaCl的含量进行测定。
Ⅰ.查阅资料:资料表明:谷氨酸钠的存在不影响NaCl含量进行测定。
Ⅱ.设计实验方案:
(1)实验原理: 。
(2)实验试剂:水、试剂X的溶液等
(3)实验过程: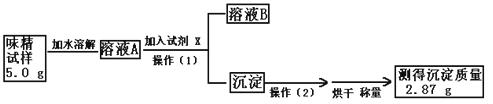
根据上述实验步骤回答下列有关问题:
①.操作(1)所需要的玻璃仪器有 。
②.操作(2)的名称为: 。
③.通过计算判断该味精中NaCl的质量分数 ,是否符合其包装上标注的标准。
_______ (填“符合”或“不符合”)
④.计算实验操作(1)所得溶液为50 mL,则溶液A中NaCl的物质的量浓度是
(第③④问写出必要的计算过程)
某探究小组同学用金属铝分别与稀盐酸或稀硫酸反应的方法研究金属与不同酸反应的差异及影响反应速率的因素.
实验药品:2.0moL/L盐酸、4.0mol/L盐酸、2.0mol/L硫酸、4.0mol/L硫酸,质量和相同的铝片和铝粉(金属表面氧化膜都已除去);每次实验各种酸的用量均为50.0mL,金属用量均为9.0g.
(Ⅰ)甲同学用铝片分别和稀盐酸、稀硫酸反应,实验及其现象如下:
| 反应进程(分钟) |
1 |
2 |
5 |
15 |
20 |
| 4.0mol/L盐酸 |
少量气泡 |
较多气泡 |
大量气泡 |
反应剧烈 |
反应结束 |
| 2.0mol/L硫酸 |
无明显现象 |
极少量气泡 |
少量气泡 |
||
| 4.0mol/L硫酸 |
无明显现象 |
少量气泡 |
有比较连续的气泡 |
请回答:
(1)写出铝与盐酸反应的离子方程式 .
(2)反应1~15min内,铝与盐酸的反应速率逐渐加快,其原因是 .
(3)以上探究铝与稀盐酸、稀硫酸反应速率有差异,你认为其原因有哪些可能?请提出你的假设(写出2种可能):
(Ⅱ)(1)乙同学设计了如下影响反应速率因素的实验(温度控制为25℃和35℃).请你根据实验目的帮助该同学完成以下实验设计表(用量:酸均为50.0mL、铝为9.0g过量):
| 实验目的 |
实验 编号 |
温度 |
金属铝 形态 |
盐酸浓度 /mol·L﹣1 |
| 1 实验①和②探究盐酸浓度对该反应速率的影响; 2实验①和③探究温度对该反应速率的影响; 3实验①和④探究金属规格(铝片、铝粉)对该反应速率的影响. |
① |
25˚C |
铝片 |
4.0 |
| ② |
||||
| ③ |
||||
| ④ |
有一固体混合物,可能由Na2CO3、Na2SO4、CuSO4、CaCl2、KCl等混合而成,为检验它们,做了如下实验:
①将固体混合物溶于水,搅拌后得无色透明溶液;
②往此溶液中滴加BaCl2溶液,有白色沉淀生成;
③过滤,将沉淀物置于足量稀硝酸中,发现沉淀全部溶解.
试判断:
(1)固体混合物中肯定有 ,肯定没有 ,可能有 .
(2)写出实验③中的离子方程式: .
(3)对可能有的物质进行确认,把③的滤液做进一步鉴别操作,写出你所设计的实验方案(包括具体操作步骤和实验现象) .
某研究性学习小组对过量炭粉与氧化铁反应的气体产物成分进行研究.
(1)提出假设
①该反应的气体产物是CO2.
②该反应的气体产物是CO.
③该反应的气体产物是 .
(2)设计方案
如图所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比.
(3)查阅资料
氮气不与碳、氧化铁发生反应.实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应制得氮气.请写出该反应的离子方程式: .
(4)实验步骤
①按图连接装置,并检查装置的气密性,称取3.20g氧化铁、2.00g碳粉混合均匀,放入48.48g的硬质玻璃管中;
②加热前,先通一段时间纯净干燥的氮气;
③停止通入N2后,夹紧弹簧夹,加热一段时间,澄清石灰水(足量)变浑浊;
④待反应结束,再缓缓通入一段时间的氮气.冷却至室温,称得硬质玻璃管和固体总质量为52.24g;
⑤过滤出石灰水中的沉淀,洗涤、烘干后称得质量为2.00g.
步骤②、④中都分别通入N2,其作用分别为 .
(5)数据处理
试根据实验数据分析,写出该实验中氧化铁与碳发生反应的化学方程式: .
(6)实验优化学习小组有同学认为应对实验装置进一步完善.
①甲同学认为:应将澄清石灰水换成Ba(OH)2溶液,其理由是 .
②从环境保护的角度,请你再提出一个优化方案将此实验装置进一步完善: .
某兴趣小组对铜与浓硫酸反应产生的黑色沉淀(可能含有CuO、CuS、Cu2S,其中CuS和 Cu2S不溶于稀盐酸、稀硫酸)进行探究,实验步骤如下:
Ⅰ.将光亮铜丝插人浓硫酸,加热;
Ⅱ.待产生大量黑色沉淀和气体时,抽出铜丝,停止加热;
Ⅲ.冷却后,从反应后的混合物中分离出黑色沉淀,洗净、干燥备用.
回答下列问题:
(1)步骤Ⅱ产生气体的化学式为 .
(2)向含微量 Cu2+试液中滴加K4[Fe(CN)6]溶液,能产生红褐色沉淀.现将少量黑色沉淀放入稀硫酸中,充分振荡以后,再滴加K4[Fe(CN)6]溶液,未见红褐色沉淀,由此所得结论是 .
(3)为证明黑色沉淀含有铜的硫化物,进行如下实验:
| 装置 |
现象 |
结论及解释 |
 |
①A试管中黑色沉淀逐渐溶解 ②A试管上方出现红棕色气体 ③B试管中出现白色沉淀 |
a.现象②说明褐色沉淀具有 性. b.试管B中产生白色沉淀的总反应的离子方程式为 |
(4)CuS固体能溶于热的浓硫酸,请用有关平衡移动原理加以解释: .
(5)为测定黑色沉淀中Cu2S 的百分含量,取0.2g 步骤Ⅰ所得黑色沉淀,在酸性溶液中用 40.0mL 0.075mol/L KMnO4溶液处理,发生反应如下:
8MnO4﹣+5Cu2S+44H+═10Cu2++5SO2↑+8Mn2++22H2O
6MnO4﹣+5CuS+28H+═5Cu2++5SO2↑+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,过量的高锰酸钾溶液恰好与35.0mL 0.1mol/L (NH4)2Fe(SO4)2溶液反应完全.则混合物中Cu2S 的质量分数为 .
池州八中一化学实验小组在同样的实验条件下,用同样的实验仪器和方法进行两组中和热测定的实验,实验试剂及用量如下表所示。
反应物 |
起始温度(0C) |
终了温度 (0C) |
中和热(kJ·mol-1) |
|
| 硫酸 |
碱溶液 |
|||
| ①0.5mol/LH2SO4溶液50ml、 1.1mol/LNaOH溶液50ml |
24.8 |
24.9 |
ΔH1 |
|
| ②0.5mol/LH2SO4溶液50ml、 1.1mol/LNH3·H2O溶液50ml |
24.8 |
24.9 |
ΔH2 |
(1)该实验小组所用的主要玻璃仪器有量筒、大小烧杯和 、
(2)实验①、②中碱液过量的目的是
(3)上表中需要测定的终了温度是
(4)该实验小组中一同学预计ΔH1≠ΔH2 ,其依据是
实验小组通过测定,实验①中放出的热量约为2.84KJ,则ΔH1=
(5)若实验①中硫酸用等体积、等浓度的盐酸代替,不考虑中和反应时HCl的挥发,则测得中和反应过程中放出的热量Q (填“偏大”、“偏小”或“不变”,下同),测得的中和热ΔH 。