池州八中一化学实验小组在同样的实验条件下,用同样的实验仪器和方法进行两组中和热测定的实验,实验试剂及用量如下表所示。
| 反应物 |
起始温度(0C) |
终了温度 (0C) |
中和热(kJ·mol-1) |
|
| 硫酸 |
碱溶液 |
|||
| ①0.5mol/LH2SO4溶液50ml、 1.1mol/LNaOH溶液50ml |
24.8 |
24.9 |
|
ΔH1 |
| ②0.5mol/LH2SO4溶液50ml、 1.1mol/LNH3·H2O溶液50ml |
24.8 |
24.9 |
|
ΔH2 |
(1)该实验小组所用的主要玻璃仪器有量筒、大小烧杯和 、
(2)实验①、②中碱液过量的目的是
(3)上表中需要测定的终了温度是
(4)该实验小组中一同学预计ΔH1≠ΔH2 ,其依据是
实验小组通过测定,实验①中放出的热量约为2.84KJ,则ΔH1=
(5)若实验①中硫酸用等体积、等浓度的盐酸代替,不考虑中和反应时HCl的挥发,则测得中和反应过程中放出的热量Q (填“偏大”、“偏小”或“不变”,下同),测得的中和热ΔH 。
正丁醚常用作有机反应的溶剂。实验室制备正丁醚的反应和主要实验装置如下:
2CH3CH2CH2CH2OH (CH3CH2CH2CH2)2O + H2O。反应物和产物的相关数据如下
(CH3CH2CH2CH2)2O + H2O。反应物和产物的相关数据如下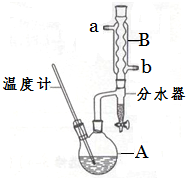
| 相对分子质量 |
沸点/℃ |
密度/(g·cm-3) |
水中溶解性 |
|
| 正丁醇 |
74 |
117.2 |
0.8109 |
微溶 |
| 正丁醚 |
130 |
142.0 |
0.7704 |
几乎不溶 |
合成反应:
①将6 mL浓硫酸和37 g正丁醇,按一定顺序添加到A中,并加几粒沸石。
②加热A中反应液,迅速升温至135℃,维持反应一段时间。
分离提纯:
③待A中液体冷却后将其缓慢倒入盛有70 mL水的分液漏斗中,振荡后静置,分液得粗产物。
④粗产物依次用40 mL水、20 mL NaOH溶液和40 mL水洗涤,分液后加入约3 g无水氯化钙颗粒,静置一段时间后弃去氯化钙。
⑤将上述处理过的粗产物进行蒸馏,收集馏分,得纯净正丁醚11 g。
请回答:
(1)步骤①中浓硫酸和正丁醇的添加顺序为 。
(2)加热A前,需先从 (填“a”或“b”)口向B中通入水。
(3)步骤③的目的是初步洗去 ,振荡后静置,粗产物应从分液漏斗的 (填“上”或“下”)口分离出。
(4)步骤④中最后一次水洗的目的为 。
(5)步骤⑤中,加热蒸馏时应收集 (填选项字母)左右的馏分。
a.100℃ b. 117℃ c. 135℃ d.142℃
(6)反应过程中会观察到分水器中收集到液体物质,且分为上下两层,随着反应的进行,分水器中液体逐渐增多至充满时,上层液体会从左侧支管自动流回A。分水器中上层液体的主要成分为 ,下层液体的主要成分为 。
(7)本实验中,正丁醚的产率为 。(保留两位有效数字)
某小组同学为比较酸性条件下NO3-、SO42-、Fe3+的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。
实验记录如下:
| 实验操作 |
实验现象 |
|
| I |
打开活塞c,将过量稀HNO3加入装置B中,关闭活塞c |
B中浅绿色溶液最终变为黄色。 |
| II |
用注射器取出少量B装置中的溶液,加入KSCN溶液 |
溶液变为红色。 |
| III |
打开活塞b,向A装置中加入足量硫酸,关闭活塞b |
A中产生气体;B中有气泡,液面上有少量红棕色气体生成。 |
| IV |
一段时间后,用注射器取出少量B装置中的溶液,…… |
…… |
| V |
打开活塞a,通入一段时间空气 |
———— |
请回答下列问题:
(1)实验I中,发生反应的离子方程式是 。
(2)实验IV的后续操作是 ,观察到的现象是 。
(3)由实验得出的结论:酸性条件下氧化性由大到小的顺序是 。
(4) 实验操作V的目的是 。
(5)实验操作III,开始时B中溶液的颜色并无明显变化,此时溶液中发生反应的离子方程式是 。
NH3是重要的化工原料。
(1)用NH4Cl和Ca(OH)2制备NH3,反应发生、气体收集和尾气处理装置依次为 。
(2)某学生用下图装置对NH3与NaClO的反应进行实验探究:
| 操作 |
现象 |
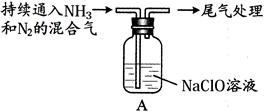 |
液面上方出现白雾 |
资料:氨和次氯酸钠溶液反应能生成肼。肼常温下是无色液体,沸点:113℃,与水混溶,它的水溶液是一种二元弱碱。
①向水中持续通入NH3,未观察到白雾。推测现象中的白雾由N2H4小液滴形成,进行实验:用湿润的红色石蕊试纸检验白雾,试纸变蓝。该实验不能判断白雾中含有N2H4,理由是 。
②进一步实验确认了A中生成了N2H4。写出A中反应的化学方程式(N2不参与反应) ;此反应中若有5.6L氨气(标准状况下)参加反应,则转移电子的数目为_______。
现使用酸碱中和滴定法测定市售白醋(CH3COOH)的总酸量(g/100 mL)。
Ⅰ.实验步骤:
(1)量取10.00 mL食用白醋,在烧杯中用水稀释后转移到100 mL________(填仪器名称)中
定容,摇匀即得待测白醋溶液。
(2)用酸式滴定管取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2滴_____作指示剂。
(3)读取盛装0.100 0 mol/L NaOH溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为________mL。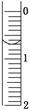
(4)滴定。滴定终点的现象是__________________________________________。
Ⅱ.数据记录:
| 滴定次数 |
1 |
2 |
3 |
4 |
| V(样品) (mL) |
20.00 |
20.00 |
20.00 |
20.00 |
| V(NaOH)(消耗) (mL) |
15.95 |
15.00 |
15.05 |
14.95 |
Ⅲ.数据处理:
某同学在处理数据时计算得:
平均消耗的NaOH溶液的体积V=(15.95+15.00+15.05+14.95)/4 mL=15.24 mL。
(5)指出他的计算的不合理之处:__________;按正确数据处理,可得市售白醋总酸量=_____g/100 mL。(结果保留四位有效数字)
某化学兴趣小组欲验证:“铜和一定量的浓硝酸反应有一氧化氮产生”。设计如下装置进行实验。(假设气体体积均为标准状况下测定,导气管中气体体积忽略不计,且忽略反应中的溶液体积变化)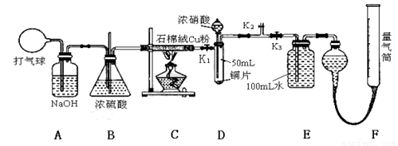
试回答下列问题:
(1)在铜和浓硝酸反应前,挤压打气球(球内充满空气),经A、B、C反应后,进入D中的气体主要成分是 (填化学式);进行此步操作时应关闭 ,打开 (填K1、K2或K3)。
(2)关闭K1、K2,打开K3,由分液漏斗向D中滴加浓硝酸,此时D中一定发生反应的离子方程式为 。待Cu和浓硝酸反应结束后,再通过分液漏斗向D中加入CCl4至满。
(3)若E装置中出现倒吸,可采取的应急操作是 。
(4)经测定,E装置中所得硝酸的物质的量浓度为0.05mol/L,实验测得F装置所收集到的气体体积为120 mL,则铜和一定量的浓硝酸反应 (填“有”或“无”)NO生成 ,其依据是(请用数据和文字说明) 。