某化学兴趣小组欲验证:“铜和一定量的浓硝酸反应有一氧化氮产生”。设计如下装置进行实验。(假设气体体积均为标准状况下测定,导气管中气体体积忽略不计,且忽略反应中的溶液体积变化)
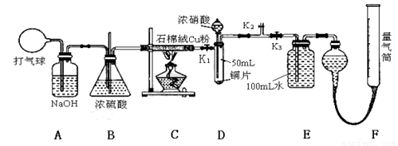
试回答下列问题:
(1)在铜和浓硝酸反应前,挤压打气球(球内充满空气),经A、B、C反应后,进入D中的气体主要成分 是 (填化学式);进行此步操作时应关闭 ,打开 (填K1、K2或K3)。
(2)关闭K1、K2,打开K3,由分液漏斗向D中滴加浓硝酸,此时D中一定发生反应的离子方程式为 。待Cu和浓硝酸反应结束后,再通过分液漏斗向D中加入CCl4至满。
(3)若E装置中出现倒吸,可采取的应急操作是 。
(4)经测定,E装置中所得硝酸的物质的量浓度为0.05mol/L,实验测得F装置所收集到的气体体积为120 mL,则铜和一定量的浓硝酸反应 (填“有”或“无”)NO生成 ,其依据是(请用数据和文字说明) 。
为验证不同化合价铁的氧化还原能力,利用下列电池装置进行实验。
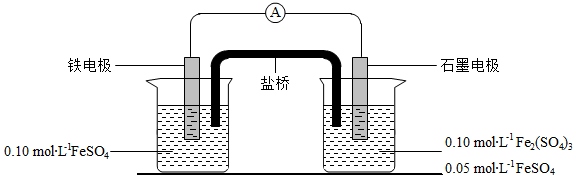
回答下列问题:
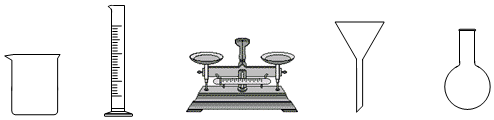
(1)由FeSO 4•7H 2O固体配制0.10mol•L ﹣ 1FeSO 4溶液,需要的仪器有药匙、玻璃棒、 (从下列图中选择,写出名称)。
(2)电池装置中,盐桥连接两电极电解质溶液。盐桥中阴、阳离子不与溶液中的物质发生化学反应,并且电迁移率(u ∞)应尽可能地相近。根据下表数据,盐桥中应选择 作为电解质。
|
阳离子 |
u ∞×10 8/(m 2•s ﹣ 1•V ﹣ 1) |
阴离子 |
u ∞×10 8/(m 2•s ﹣ 1•V ﹣ 1) |
|
Li + |
4.07 |
HCO 3 ﹣ |
4.61 |
|
Na + |
5.19 |
NO 3 ﹣ |
7.40 |
|
Ca 2+ |
6.59 |
Cl ﹣ |
7.91 |
|
K + |
7.62 |
SO 4 2 ﹣ |
8.27 |
(3)电流表显示电子由铁电极流向石墨电极。可知,盐桥中的阳离子进入 电极溶液中。
(4)电池反应一段时间后,测得铁电极溶液中c(Fe 2+)增加了0.02mol•L ﹣ 1.石墨电极上未见Fe析出。可知,石墨电极溶液中c(Fe 2+)= 。
(5)根据(3)、(4)实验结果,可知石墨电极的电极反应式为 ,铁电极反应式为 。因此,验证了Fe 2+氧化性小于 ,还原性小于 。
(6)实验前需要对铁电极表面活化。在FeSO 4溶液中加入几滴Fe 2(SO 4) 3溶液,将铁电极浸泡一段时间,铁电极表面被刻蚀活化。检验活化反应完成的方法是 。
羟基乙酸钠易溶于热水,微溶于冷水,不溶于醇、醚等有机溶剂。制备少量羟基乙酸钠的反应为ClCH2COOH+2NaOH→HOCH2COONa+NaCl+H2O△H<0
实验步骤如下:
步骤1:在如图所示装置的反应瓶中,加入40g氯乙酸、50mL水,搅拌。逐步加入40% NaOH溶液,在95℃继续搅拌反应2小时,反应过程中控制pH约为9。
步骤2:蒸出部分水至液面有薄膜,加少量热水,趁热过滤。滤液冷却至15℃,过滤得粗产品。
步骤3:粗产品溶解于适量热水中,加活性炭脱色,分离掉活性炭。
步骤4:将去除活性炭后的溶液加到适量乙醇中,冷却至15℃以下,结晶、过滤、干燥,得羟基乙酸钠。
(1)步骤1中,如图所示的装置中仪器A的名称是 ;逐步加入NaOH溶液的目的是 。
(2)步骤2中,蒸馏烧瓶中加入沸石或碎瓷片的目的是 。
(3)步骤3中,粗产品溶解于过量水会导致产率 ( 填“增大”或“减小”);去除活性炭的操作名称是 。
(4)步骤4中,将去除活性炭后的溶液加到适量乙醇中的目的是 。

以铁、硫酸、柠檬酸、双氧水、氨水等为原料可制备柠檬酸铁铵[(NH4)3Fe(C6H5O7)2].
(1)Fe基态核外电子排布式为 ;[Fe(H2O)6]2+中与Fe2+配位的原子是 (填元素符号).
(2)NH3分子中氮原子的轨道杂化类型是 ;C、N、O元素的第一电离能由大到小的顺序为 .
(3)与NH4+互为等电子体的一种分子为 (填化学式).
(4)柠檬酸的结构简式如图.1mol柠檬酸分子中碳原子与氧原子形成的σ键的数目为 mol.

CO2/HCOOH循环在氢能的贮存/释放、燃料电池等方面具有重要应用。
(1)CO2催化加氢。在密闭容器中,向含有催化剂的KHCO3溶液(CO2与KOH溶液反应制得)中通入H2生成HCOO﹣,其离子方程式为 ;其他条件不变,HCO3﹣转化为HCOO﹣的转化率随温度的变化如图1所示。反应温度在40℃~80℃范围内,HCO3﹣催化加氢的转化率迅速上升,其主要原因是 。

(2)HCOOH燃料电池。研究HCOOH燃料电池性能的装置如图2所示,两电极区间用允许K+、H+通过的半透膜隔开。
①电池负极电极反应式为 ;放电过程中需补充的物质A为 (填化学式)。
②如图2所示的HCOOH燃料电池放电的本质是通过HCOOH与O2的反应,将化学能转化为电能,其反应的离子方程式为 。
(3)HCOOH催化释氢。在催化剂作用下,HCOOH分解生成CO2和H2可能的反应机理如图3所示。
①HCOOD催化释氢反应除生成CO2外,还生成 (填化学式)。
②研究发现:其他条件不变时,以HCOOK溶液代替HCOOH催化释氢的效果更佳,其具体优点是 。
实验室由炼钢污泥(简称铁泥,主要成分为铁的氧化物)制备软磁性材料α﹣Fe2O3.其主要实验流程如图。

(1)酸浸。用一定浓度的H2SO4溶液浸取铁泥中的铁元素。若其他条件不变,实验中采取下列措施能提高铁元素浸出率的有 (填序号)。
A.适当升高酸浸温度
B.适当加快搅拌速度
C.适当缩短酸浸时间
(2)还原。向“酸浸”后的滤液中加入过量铁粉,使Fe3+完全转化为Fe2+.“还原”过程中除生成Fe2+外,还会生成 (填化学式);检验Fe3+是否还原完全的实验操作是 。
(3)除杂。向“还原”后的滤液中加入NH4F溶液,使Ca2+转化为CaF2沉淀除去。若溶液的pH偏低,将会导致CaF2沉淀不完全,其原因是 [Ksp(CaF2)=5.3×10﹣9,Ka(HF)=6.3×10﹣4]。
(4)沉铁。将提纯后的FeSO4溶液与氨水﹣NH4HCO3混合溶液反应。生成FeCO3沉淀。
①生成FeCO3沉淀的离子方程式为 。
②设计以FeSO4溶液、氨水﹣NH4HCO3混合溶液为原料,制备FeCO3的实验方案: [FeCO3沉淀需“洗涤完全”,Fe(OH)2开始沉淀的pH=6.5]。