某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。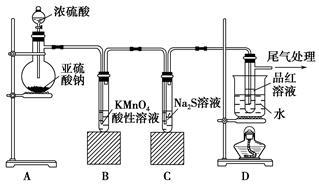
请回答下列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是________,其中发生反应的化学方程式为________________
(2)实验过程中,装置B、C中发生的现象分别是________________、________________,这些现象分别说明SO2具有的性质是____________和____________;
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象_________________
(4)尾气可采用__________溶液吸收。
实验室里通常用MnO2与浓盐酸反应制取氯气。现用下列有关装置先制取干燥、纯净的氯气。后进行有关性质实验。试根据下列有关装置回答有关问题。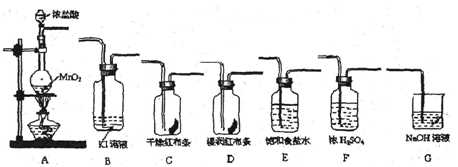
(1)上述装置中各仪器从左至右的连接顺序为A接接接接接接G。
(2)E装置的作用是,D中的现象为,
B中的现象为________________________。
(3)写出相关反应的离子方程式:A中,
G中。
(4)某温度下,将Cl2通入NaOH溶液中,反应得到含有ClO-与ClO3- 物质的量之比为1:1的混合液,反应的化学方程式是______________________________________。
(5) 报纸报道了多起卫生间清洗时,因混合使用“洁厕灵”(主要成分是盐酸)与“84消毒液”(主要成分是NaClO)发生氯气中毒的事件。试根据你的化学知识分析,原因是(用离子方程式表示)_______________________________________。
某化学小组同学发现84消毒液(主要成分为NaClO)与洁厕剂(主要成分为盐酸)室温下混和有Cl2生成,于是尝试在实验室利用该反应原理制取Cl2。
(1)若用次氯酸钙、浓盐酸为原料,利用下图装置制取Cl2。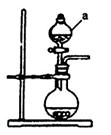
装置中仪器a的名称为。
甲同学想证明Cl2溶于水有酸性物质生成,将发生装置产生的气体直接通入适量水中,并加入NaHCO3粉末,有无色气泡产生。乙同学认为不合理,理由是。
又知:室温下H2CO3的电离常数K1=4.2×10-7,K2=5.6×10-11,则pH为8.0的NaHCO3溶液中c(CO32-):c(HCO3-)=。
(2)经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。设计如下装置制备无水FeCl3。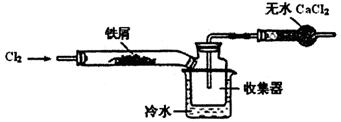
①下列操作步骤的正确排序为(填字母)。
a.体系冷却后,停止通入Cl2
b.通入干燥的Cl2赶尽装置中的空气
c.在铁屑下方加热至反应完成
d.用干燥的H2赶尽Cl2
e.检验装置的气密性
②该实验装置存在的明显缺陷是。
(3)世界环保联盟要求ClO2逐渐取代Cl2作为自来水消毒剂。
已知:NaCl+3H2O  NaClO3+3H2
NaClO3+3H2 ,2NaClO3+4HCl=2C1O2
,2NaClO3+4HCl=2C1O2 +Cl2
+Cl2 +2NaCl+2H2O。
+2NaCl+2H2O。
有关物质性质:
| 物质 |
熔点/℃ |
沸点/℃ |
| C1O2 |
-59 |
11 |
| Cl2 |
-107 |
-34.6 |
ClO2的生产流程示意图:
该工艺中,需要补充的物质X为(填化学式),能参与循环的物质是(填化学式)。从ClO2发生器中分离出ClO2可采用的方法是。
Ⅰ.无水氯化铝是有机化工常用催化剂,其外观为白色固体,178℃时升华,极易潮解,遇水后会发热并产生白雾。实验室用如下装置制备少量无水氯化铝,其反应原理为:2Al + 6HCl(g) = 2AlCl3 + 3H2
完成下列填空: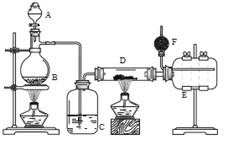
A为浓硫酸,B为NaCl固体
(1)进行实验时应先点燃(选填“B”或“D”)处酒精灯。
(2)用粗短导管连接D、E的目的是________(选填序号)。
a.防堵塞 b.防倒吸c.平衡气压 d.冷凝回流
(3)F中盛有碱石灰,其目的是(选填序号)。
a.吸收多余HClb.吸收Cl2
c.吸收CO2d.防止空气中H2O进入E瓶
(4)将D中固体改为氯化铝晶体(AlCl3·6H2O)也能进行无水氯化铝的制备,此时通入HCl气体的目的是。若实验条件控制不当,最终得到的物质是碱式氯化铝[化学式为Al2(OH)nCl(6-n)],且质量是原氯化铝晶体(AlCl3·6H2O)的40%,则可推算n的值为。
Ⅱ.焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。Na2S2O5溶于水即生成NaHSO3。
(1)证明NaHSO3溶液中HSO3—的电离程度大于水解程度,可采用的实验方法是(填序号)。
a.测定溶液的pH
b.加入Ba(OH)2溶液
c.加入盐酸
d.加入品红溶液
e.用蓝色石蕊试纸检测
(2)检验Na2S2O5晶体在空气中已被氧化的实验方案是______________。
(3)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量的方案如下:
(已知:滴定时反应的化学方程式为SO2 + I2 + 2 H2O = H2SO4 + 2 HI)
按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为g/L。在上述实验过程中,若有部分HI被空气氧化,则测得结果(填“偏高”、“偏低”或“不变”)。
高锰酸钾是一种典型的强氧化剂,无论在实验室还是在化工生产中都有重要的应用。如图K103是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。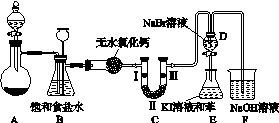
图K103
(1)制备氯气选用的药品为高锰酸钾和浓盐酸,相应的离子方程式为___________________________。
(2)装置B的作用是________________________,实验进行时C中可能发生堵塞,请写出发生堵塞时B中的现象:______________________________________。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入____(选“a”“b”或“c”)。
| a |
b |
c |
|
| I |
干燥的有色布条 |
湿润的有色布条 |
湿润的有色布条 |
| Ⅱ |
碱石灰 |
浓硫酸 |
无水氯化钙 |
| Ⅲ |
湿润的有色布条 |
干燥的有色布条 |
干燥的有色布条 |
(4)设计装置D、E的目的是比较氯、溴、碘的非金属性。当向D中缓缓通入足量氯气时,可以看到无色溶液逐渐变为红棕色,说明氯的非金属性大于溴。打开活塞,将D中的少量溶液加入E中,振荡E,观察到的现象是________________________________。该现象________(填“能”或“不能”)说明溴的非金属性强于碘。
某研究性学习小组在网上收集到如下信息:钾、钙、钠、镁等活泼金属都能在CO2气体中燃烧。他们对钠在CO2气体中燃烧后的产物中的白色物质进行了如下探究:
[实验]将燃烧的钠迅速伸入装满CO2的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底附着黑色颗粒,瓶壁上粘附着白色物质。
[提出假设]
假设1:白色物质是Na2O。
假设2:白色物质是Na2CO3。
假设3:白色物质是Na2O和Na2CO3的混合物。
[设计实验方案验证假设]该小组对燃烧后的白色产物进行如下探究:
| 实验 方案 |
实验操作 |
实验 现象 |
结论 |
| 方案1 |
取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 |
溶液变 成红色 |
白色物质为Na2O |
| 方案2 |
①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2溶液 |
出现白 色沉淀 |
|
| ②静置片刻,取上层清液于试管中,滴加无色酚酞试液 |
无明显现象 |
(1)甲同学认为方案1得到的结论不正确,其理由是____________________。
(2)乙同学认为方案2得到的结论正确,白色物质为____________________。
(3)通过方案1和方案2的实验,你认为上述三个假设中,________成立。
(4)钠在二氧化碳中燃烧的化学方程式为__________________________________________。
(5)丙同学认为白色物质有可能是氢氧化钠。你是否同意丙同学的观点,并简述理由:______________、
________________________________________________________。