Ⅰ.无水氯化铝是有机化工常用催化剂,其外观为白色固体,178℃时升华,极易潮解,遇水后会发热并产生白雾。实验室用如下装置制备少量无水氯化铝,其反应原理为:2Al + 6HCl(g) = 2AlCl3 + 3H2
完成下列填空: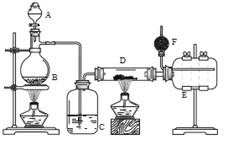
A为浓硫酸,B为NaCl固体
(1)进行实验时应先点燃 (选填“B”或“D”)处酒精灯。
(2)用粗短导管连接D、E的目的是________(选填序号)。
a.防堵塞 b.防倒吸 c.平衡气压 d.冷凝回流
(3)F中盛有碱石灰,其目的是 (选填序号)。
a.吸收多余HCl b.吸收Cl2
c.吸收CO2 d.防止空气中H2O进入E瓶
(4)将D中固体改为氯化铝晶体(AlCl3·6H2O)也能进行无水氯化铝的制备,此时通入HCl气体的目的是 。若实验条件控制不当,最终得到的物质是碱式氯化铝[化学式为Al2(OH)nCl(6-n)],且质量是原氯化铝晶体(AlCl3·6H2O)的40%,则可推算n的值为 。
Ⅱ.焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。Na2S2O5溶于水即生成NaHSO3。
(1)证明NaHSO3溶液中HSO3—的电离程度大于水解程度,可采用的实验方法是 (填序号)。
a.测定溶液的pH
b.加入Ba(OH)2溶液
c.加入盐酸
d.加入品红溶液
e.用蓝色石蕊试纸检测
(2)检验Na2S2O5晶体在空气中已被氧化的实验方案是________ ______。
(3)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量的方案如下:
(已知:滴定时反应的化学方程式为SO2 + I2 + 2 H2O = H2SO4 + 2 HI)
按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为 g/L。在上述实验过程中,若有部分HI被空气氧化,则测得结果 (填“偏高”、“偏低”或“不变”)。
某合作学习小组分别利用装置Ⅰ、Ⅱ探究铜与硝酸的反应。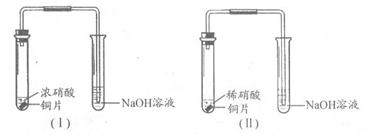
(1)Ⅰ中反应的离子方程式为 ;
Ⅱ中反应的化学方程式为 ;
比较装置Ⅰ、Ⅱ中的反应现象,其不同点是;
;
(2)该小组给Ⅰ反应后的溶液用小火加热一会儿,然后自然冷却。实验中观察到:试管上部气体颜色变深,并发现氢氧化钠溶液完全倒吸。倒吸后,试管中混合液呈淡蓝色,试管中有色气体消失。
①“试管上部气体颜色变深”的可能原因是 ;
②“倒吸”的原因是 ;
③“溶液呈淡蓝色”的可能原因是 。
某课外小组设计的实验室制取乙酸乙酯的装置(如图所示),A中放有浓硫酸,B中放有乙醇、无水醋酸,D中放有饱和碳酸钠溶液。按图连接装置,用酒精灯对烧瓶B加热,当观察到D中有明显现象时停止实验。试完成下列问题:
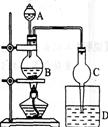
(1)在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入几块碎瓷片,其目的是:_________。
(2)球形干燥管除起冷凝作用外,另一重要作用是_________________。
(3)装置D中饱和碳酸钠溶液的作用是___________________________
(4)在该实验中,若用1mol乙醇和1mol 乙酸在浓硫酸作用下加热,充分反应,能否生成1mol乙酸乙酯?,原因是:。
实验室常用如右图所示装置来进行铜跟浓硫酸反应等一系列实验。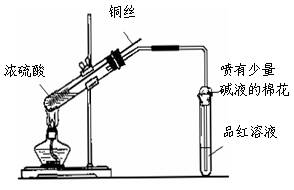
(1)根据什么现象可判断铜跟浓硫酸反应有SO2生成____________。根据什么现象可判断铜跟浓硫酸反应有硫酸铜生成__________。写出甲装置中发生的主要反应的化学方程式_____________。
(2)你在实验室中进行这个实验时,除了(1)小题中指到的实验现象外,还可以观察到许多其它的实验现象,请写出两种:__________、_____________。
(3)装置乙的试管口部放有一团浸有碱液的棉花,棉花中通常是浸有饱和碳酸钠溶液,写出棉花中发生反应的化学方程式_________________________________。
将下列实验所需的试剂填入空格处,不需加试剂的填写操作方法。
(1)做碘升华实验留下的碘,用洗涤。
(2)用高锰酸钾制取氧气的试管里,附于内壁的黑色固体物质,需用洗涤。
(3)二氧化硅中含有少量氧化铁,需用除杂。
(4)碳酸钠固体中混有少量碳酸氢钠,需用除杂。
为了验证浓H2SO4和木炭在加热时发生反应生成的各种产物,甲、乙两学生分别设计如下实验方案:(图中→表示气体流向)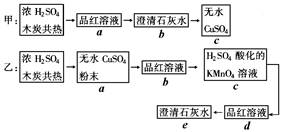
(1)上述方案可达到实验目的的是______________(填“甲”或“乙”)。
(2)具体说明能达到实验目的的方案中,气体通过的各装置(用字母表示)的作用:。