某研究性学习小组同学设计了如下图制取氯气(药品:MnO2和浓盐酸)并验证其性质的实验装置。
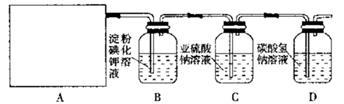
请回答下列问题:(1)该实验中A部分的装置是 (填写装置的序号)

(2)A中发生反应一段时间后,B中的现象是 ;
整套实验装置存在的明显缺陷是 。
(3)写出D装置中发生反应的离子方程式: 。
(4)请你帮该小组同学设计一个实验,证明洗气瓶C中的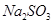 已被氧化(简述实验步骤): 。
已被氧化(简述实验步骤): 。
工业上以黄铁矿为原料生产硫酸主要分为三个阶段进行,即在沸腾炉中煅烧黄铁矿、SO2的催化氧化及其SO3的吸收。请回答下列几个有关硫酸工业中的几个问题。
(1)生产硫酸最古老的方法是以绿矾为原料,在蒸馏釜中煅烧。反应的化学方程式为:2FeSO4·7H2O  Fe2O3 + SO2↑+ SO3↑+ 14H2O。其中三氧化硫与水蒸气同时冷凝便得到硫酸。用如图所示装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和二氧化硫(加热装置已略去)。其中b为干燥的试管。下列关于该反应说法正确的是( )
Fe2O3 + SO2↑+ SO3↑+ 14H2O。其中三氧化硫与水蒸气同时冷凝便得到硫酸。用如图所示装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和二氧化硫(加热装置已略去)。其中b为干燥的试管。下列关于该反应说法正确的是( )
| A.若将反应后的三种气体通入BaCl2溶液中,产生的沉淀为BaSO3、BaSO4 |
| B.b中产物用紫色石蕊试液即可检验出其中H+和SO42— |
| C.为检验反应的另一种生成物,试管c中应加入的试剂为NaOH溶液 |
| D.b中所得到的硫酸的质量分数为29.5% |
(2)从沸腾炉中出来的炉气必须经除尘、洗涤、干燥后进入接触室,其主要目的是__________。
(3)接触室中热交换器是实现冷热交换的装置。化学实验中也经常利用热交换来实现某种实验目的,如气、液热交换时通常使用的仪器是______________。
(4)接触室中主要反应是SO2的催化氧化,在生成硫酸的过程中,钒触媒(V2O5)所以能加快二氧化硫氧化的速度,除了具有吸附作用外,有人认为反应过程中还产生了一连串的中间体(如图)。c步的化学方程式可表示为_______________________。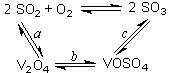
(5) 工业上以硫铁矿为原料制硫酸所产生的尾气除了含有N2、O2外,还含有SO2、微量的SO3和酸雾。为了保护环境,同时提高硫酸工业的综合经济效益,应尽可能将尾气中的SO2转化为有用的副产品。将尾气通入粉末状的碳酸钙或熟石灰的悬浊液中,经过一系列处理后得到一种相对分子质量为172的化工原料J。试写出J的化学式_________。
某同学设计如图所示装置分别进行探究实验(夹持装置已略去)
| 实验 |
药品 |
制取气体 |
量气管中的液体 |
| ① |
Cu、稀HNO3 |
NO |
H2O |
| ② |
FeCl3溶液、双氧水 |
H2O |
|
| ③ |
Zn、稀H2SO4 |
H2 |
H2O |
| ④ |
NaOH固体、浓氨水 |
NH3 |
|
| ⑤ |
Na2CO3固体、稀H2SO4 |
CO2 |
|
| ⑥ |
镁铝合金、NaOH溶液(足量) |
H2 |
H2O |
请回答下列问题:
(1)本实验应对量气管多次读数,读数时应注意
①,
②,③视线与凹液面最低处相平。
(2)实验②收集的气体是。
(3)若向实验③反应体系中加少量CuSO4溶液,反应速率加快,原因是。
(4)实验④、⑤中,量气管中的液体分别是、。
| A.稀H2SO4 | B.CCl4 | C.饱和Na2CO3溶液 | D.饱和NaHCO3溶液 |
(5)在25℃,101kPa条件下,取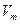 =24.0L/mol。实验⑥数据如下:
=24.0L/mol。实验⑥数据如下:
| 编号 |
镁铝合金质量 |
量气管第一次读数 |
量气管第二次读数 |
| 1 |
1.0g |
20.0mL |
382.2mL |
| 2 |
1.0g |
20.0mL |
360.0mL |
| 3 |
1.0g |
20.0mL |
377.8mL |
根据上述合理数据计算镁铝合金中铝的质量分数。
某化学课外活动小组设计实验探究氮的化合物的性质,装置如下图所示(A装置未画出),其中A为气体发生装置。A中所用试剂从下列固物质中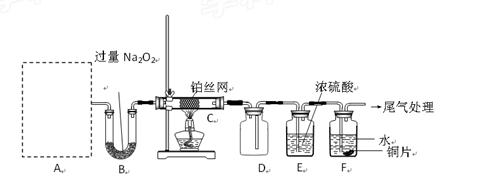
a. NH4HCO3、b. NH4Cl、c. Ca(OH)2、d. NaOH。
检查装置气密性后,先将C处铂丝网加热至红热,再将A处产生的气体通过B装置片刻后,撤去C处酒精灯。部分实验现象如下:铂丝继续保持红热,F处铜片逐渐溶解。
(1)实验室制取A中气体时若只用一种试剂,该试剂是________(填备选试剂的字母);此时A中主要的玻璃 仪器有________________(填名称)。
仪器有________________(填名称)。
(2)A中产生的物质被B中Na2O2充分吸收,写出任意一个B中发生反应的化学方程式:_____________________。
(3)对于C中发生的可逆反应,下列说法正确的是________。
a. 增大一种反应物的浓度可以提高另一种反应物的转化率
b. 工业上进行该反应时,可采取高压的条件提高反应物转化率
c. 该反应在一定条件下达到平衡时,反应物的平衡浓度之比一定是4∶5
(4)请在下图坐标中画出C装置中反应发生过程中的能量变化示意图,并在虚线上分别标出反应物和生成物的化学式。
(5)待实验结束后,将B中固体混合物溶于500mL1mol·L-1盐酸中,产生无色混合气体甲,溶液呈中性,则实验前B中原有Na2O2的物质的量是____mol,甲在标准状况下是_____L(忽略气体的溶解)。
某化学课外活动小组进行了一系列“带火星的木条复燃”的实验,实验装置如下图。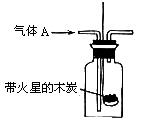
(1)甲组同学探究“使带火星木条复燃时O2的体积分数的极限”。将氧气和空气(假定空气中O2的体积分数为20%)按不同的体积比混合得100mL气体A进行实验,实验记录如下: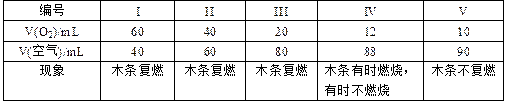
回答问题:
①使带火星木条复燃的O2的体积分数最小(第IV组数据)约为____________。
②用带火星木条检验集气瓶里是否集满O2,若木条复燃,能否认为集气瓶里的气体一定是纯净的O2?答:__________(填“能”或“否”)。
③若按照3:2的比例混合O2和CO2气体,该混合气体能否使带火星的木条复燃?答:___________(填“能”“否”或“不一定”)。
(2)乙组同学探究“NO2能否支持燃烧”的问题,设计了如下几组实验,实验记录及结论如下:
| 编号 |
制取气体A(下列反应产生的混合气体) |
B中的现象 |
结论 |
| a |
在烧瓶中加热适量浓HNO3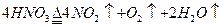 |
充满红棕色气体,木条不复燃,火星熄灭 |
NO2不支持燃烧 |
| b |
加热AgNO3固体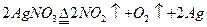 |
充满红棕色气体,木条复燃 |
NO2支持燃烧 |
| c |
加热Cu(NO3)2固体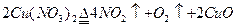 |
充满红棕色气体,木条复燃 |
NO2支持燃烧 |
你认为a、b、c三个结论是否可靠?若不可靠,说明原因;若可靠,则不需说明。
a. ___________,原因是______________________________。
b. ___________,原因是______________________________。
c. ___________,原因是______________________________。
向溴水中加入足量乙醛溶液,可以观察到溴水褪色。对产生该现象的原因有如
下三种猜想:①溴水与乙醛发生了取代反应;②溴水与乙醛发生了加成反应③溴水将乙醛氧化成乙酸。为探究哪一种猜想正确,一研究性学习小组提出了如下两种实验方案:
方案一:检验褪色后溶液的酸碱性
方案二:测定反应前溴水中Br2的物质的量和反应后Br-的物质的量
(1)方案一是否可行?,理由
(2)假设方案二中测得反应前溴水中Br2的物质的量为a mol,若测得反应后n(Br-)=
mol,说明溴水与乙醛发生了取代反应;若测得反应后n(Br-)=mol,说明溴水与乙醛发生了加成反应;若测得反应后n(Br-)=mol,则说明溴水将乙醛氧化成乙酸。