向溴水中加入足量乙醛溶液,可以观察到溴水褪色。对产生该现象的原因有如
下三种猜想:①溴水与乙醛发生了取代反应;②溴水与乙醛发生了加成反应③溴水将乙醛氧化成乙酸。为探究哪一种猜想正确,一研究性学习小组提出了如下两种实验方案:
方案一:检验褪色后溶液的酸碱性
方案二:测定反应前溴水中Br2的物质的量和反应后Br-的物质的量
(1)方案一是否可行? ,理由
(2)假设方案二中测得反应前溴水中Br2的物质的量为a mol,若测得反应后n(Br-)=
mol,说明溴水与乙醛发生了取代反应;若测得反应后n(Br-)= mol,说明溴水与乙醛发生了加成反应;若测得反应后n(Br-)= mol,则说明溴水将乙醛氧化成乙酸。
(Ⅰ)本世纪是生命科学研究的昌盛时期, 科学家研究发现,进入生物体内的氧分子,可接受1个电子转变为超氧阴离子自由基(O2-),进而引发产生一系列自由基。一切需氧生物在其机体内均有一套完整的活性氧系统(抗氧化酶和抗氧化剂),能将活性氧转变为活性较低的物质,机体因此受到保护。人们利用羟胺(NH2OH)氧化的方法可以检测其生物系统中O2-含量,原理是O2-与羟胺反应生成NO2-和一种过氧化物。NO2-在对氨基苯磺酸和α-萘胺作用下,生成粉红的偶氮染体,染体在波长530nm处有显著吸收,且其吸收值与c(NO2-)成正比,从而可计算出样品中的O2-含量。某实验室用以上方法处理后测得溶液中c(NO2-)=2.500×10-3 mol∙L-1。
科学家研究发现,进入生物体内的氧分子,可接受1个电子转变为超氧阴离子自由基(O2-),进而引发产生一系列自由基。一切需氧生物在其机体内均有一套完整的活性氧系统(抗氧化酶和抗氧化剂),能将活性氧转变为活性较低的物质,机体因此受到保护。人们利用羟胺(NH2OH)氧化的方法可以检测其生物系统中O2-含量,原理是O2-与羟胺反应生成NO2-和一种过氧化物。NO2-在对氨基苯磺酸和α-萘胺作用下,生成粉红的偶氮染体,染体在波长530nm处有显著吸收,且其吸收值与c(NO2-)成正比,从而可计算出样品中的O2-含量。某实验室用以上方法处理后测得溶液中c(NO2-)=2.500×10-3 mol∙L-1。
⑴ 请根据测定原理写出有关反应的离子方程式 ▲;
⑵ 计算该样品此时c(O2-) = ▲;
⑶ 如用羟胺氧化法测定O2-时,将其生成的过氧化物作为检测物,若选用氧化还原法进行定量分析(用KMnO4标准溶液进行滴定)
① 请写出其测定原理的反应方程式 ▲;
② 测定所用的主要玻璃仪器为 ▲,通过观察 ▲的现象可确定测定反应是否进行完全。
(Ⅱ)水中的NO2-是含氮有机物分解的产物,其浓度的大小是水源污染的标志之一。检测水中的NO2-可用比色法,其步骤是:
a. 配制标准溶液:称取0.30gNaNO2,溶于水后在容量瓶中稀释至1L得溶液A,移取5mL溶液A,稀释至1L,得溶液B。
b. 配制标准色阶:取6只规格为10mL的比色管(即质地、大小、厚薄相同且具塞的平
底试管),分别加入体积不等的溶液B,并稀释至10mL,再加入少许(约0.3g)对苯磺酸粉末,实验结果如下表所示:
| 色阶序号 |
1 |
2 |
3 |
4 |
5 |
6 |
| 加入溶液B的体积(mL) |
0 |
2.0 |
4.0 |
6.0 |
8.0 |
10.0 |
| 反应后溶液颜色 |
由无色变为由浅到深的樱桃红色 |
c. 检测:取10mL水样倒入比色管中,加少许对氨基苯磺酸,显色后与标准色阶对比。请填写以下空白:
① 比色法的基本依据是 ▲;
② 若水样显色后与色阶中的5号颜色相同,则表明水样中NO2-含量为 ▲mg/L。
③ 用NaNO2直接配制溶液B的缺点是 ▲。
④ 如果水样显色后比6号还深,应采取的措施是 ▲。
某校化学研究性学习小组的同学在学习了氨的性质后讨论:运用类比的思想,既然氨气具有还原性,能否像H2那样还原CuO呢?他们设计实验制取氨气并探究上述问题。请你参与该小组的活动并完成下列研究:
(一)制取氨气
(1)写出实验制取氨气的化学方程式 ; (2)有同学模仿排饱和食盐水收集氯气的方法,想用排饱和氯化铵溶液的方法收集氨气。你认为他能否达到目的? (填“能”或“否”),理由是 。
(二)该小组中某同学设计了如下图所示的实验装置(部分夹持及尾气处理装置未画出),探究氨气的还原性:
(3)该装置在设计上有一定缺陷,为保证实验结果的准确性,对该装置的改进措施是
(4)利用改进后的装置进行实验,观察到CuO变为红色物质,无水CuSO4变蓝色,同时生成一种无污染的气体。写出氨气与CuO反应的化学方程式 。
。
(三)问题讨论
(5)有同学认为:NH3与CuO反应生成的红色物质可能含有Cu2O。已知:Cu2O是一种碱性氧化物;在酸性溶液中,Cu+ 的稳定性比Cu2+ 差(Cu+ Cu+Cu2+)。请你设计一个简单的实验检验该红色物质中是否含有Cu2O 。
Cu+Cu2+)。请你设计一个简单的实验检验该红色物质中是否含有Cu2O 。
(6)解决了问题(5)后,有同学提出:Cu2O与CuO的热稳定性哪个更强?于是他们进行了如下实验:取98 g Cu(OH)2固体,加热至80℃~100℃时,得到黑色固体粉末,继续加热到1000℃以上,黑色粉末全部变为红色粉末A。冷却 后称量,A的质量为72 g。据此可推得,A的化学式为 。由此,得到的结论是__________________
后称量,A的质量为72 g。据此可推得,A的化学式为 。由此,得到的结论是__________________ ______________。
______________。
现有氧化铜和铜粉组成的混合物。某同学利用下图所示装置,通过测定 混合物质量、实验前后U型管质量变化来确定混合物中氧化铜的质量分数。
混合物质量、实验前后U型管质量变化来确定混合物中氧化铜的质量分数。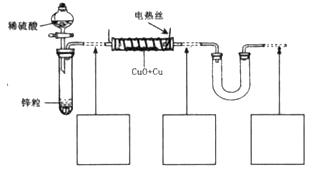
回答下列问题:
(1)U形管中可以加入的物质是_________(填序号);
A、浓 B、无水硫酸铜粉末 C、无水氯化钙颗粒
B、无水硫酸铜粉末 C、无水氯化钙颗粒
(2)下列步骤按实验操作顺序应为_________(填字母);
A.停止通氢气; B.电热丝通电; C.通人氢气;
D.装置气密性检查; E.电热丝停止通电。
(3)为准确测定数据,你认为本装置是否完整?若需要改进,请在图中虚线下面的方框内画出所需添加的装置示意图并注明必要的物质名称。若无需改进,则将装置图中虚线部分改为实线;
(4)实验结束后,该同学交给老师的实验报告主要项目如图(具体内容已略)。请你根据实验报告的撰写要求,对此份报告作出评价,若已完整,则无需填写,若不完整,请在下面的空格中写出所缺项目______ _
(5)老师看完实验报告后指出,改变实验原理可以设计出更加简便的实验方案。请用化学方程式表示你设计的新方案的反应原理____ ______,该方案需测定的数据______________。
(16分)有关催化剂的催化机理可以从“乙醇催化氧化实 验”得到一些认识,某老师设计了如图装置(夹
验”得到一些认识,某老师设计了如图装置(夹 持装置仪器已省略),其实验操作为:先按图安装好,先关闭活塞a、b、c,在铜丝的中间部分加热片刻,然后打开活塞a
持装置仪器已省略),其实验操作为:先按图安装好,先关闭活塞a、b、c,在铜丝的中间部分加热片刻,然后打开活塞a 、b、c,通过控制活塞a和b,而有节奏(间歇性)通入气体,即可在M处观察到明显的实验现象。试回答以下问题:
、b、c,通过控制活塞a和b,而有节奏(间歇性)通入气体,即可在M处观察到明显的实验现象。试回答以下问题: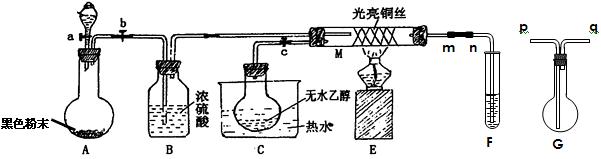
(1)检验装置A气密性的方法是,
A中发生反应的化学方程式为,
C中烧瓶常常浸在70~80℃的热水中,目的是。
(2)M管中可观察到的现象为,从中可认识到该实验过程的催化剂是。
(3)若试管F中用水吸收产物, 则要在导管m、n之间接上G装置,其连接方法是(填G装置中导管的代号):m接______、_______接n,G装置的作用是;若产物不用水吸收而是直接冷却,应将试管F浸在中。
则要在导管m、n之间接上G装置,其连接方法是(填G装置中导管的代号):m接______、_______接n,G装置的作用是;若产物不用水吸收而是直接冷却,应将试管F浸在中。
Ⅰ.下列操作正确的是_______.
| A.用氨水清洗做过银镜反应的试管 |
| B.用酒精清洗有硫沉淀的试管 |
| C.用碱式滴定管量取20.00 mL 0.1000 mol/L KMnO4溶液; |
| D.配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加入浓硫酸 |
E、如果苯酚浓溶液沾到皮肤上,应立即用70℃以上的水清洗
F、不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸溶液
G、用托盘天平称取10.50 g干燥的NaCl固体;
H、向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,以制备Fe(OH)3胶体;
I、配制Al2(SO4)3溶液时,加入少量的稀硫酸。
Ⅱ.用下图装置进行SO2转化为SO3的转化率测定实验:
(1)写出圆底烧瓶中发生反应的化学方程式
(2)实验前,必须进行的操作是(填操作名称,不必写具体过程) 。
(3)从乙处均匀通入O2,为使SO2有较高的转化率,实验时滴入浓硫酸与加热催化剂的先后顺序是。
(4)本实验装置设计中有不恰当的地方,请指出: 。
所增加装置的目的是 。
(5)将反应生成的44.8L(标况下)SO2气体全部通过硬质玻璃管后,在右侧烧杯的试管中得到152g固体,则SO2的转化率为