I.实验室制备、收集干燥的SO2,所需仪器如下。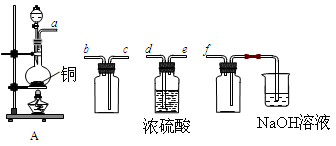
(1)装置A产生SO2,按气流方向连接各仪器接口,顺序为a→ ____→ ____ →____→____f。
(2)装置A中发生反应的化学方程式为____________________________________。
(3)验证产生的气体是SO2的方法是________________________________________。
II.SO2气体为无色气体,有强烈刺激性气味,大气主要污染物之一,具有一定的还原性,探究SO2气体还原Fe3+、I2可以使用的药品和装置如图所示: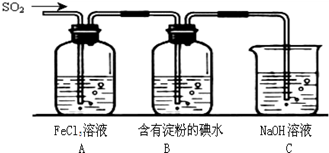
(1)装置A中的现象是__________。在SO2还原Fe3+的反应中SO2和Fe3+的物质的量之比是_______。
(2)装置C的作用是____________________________________。
(3)若要从A中的FeCl3溶液中提取晶体,必须进行的实验操作步骤:加热浓缩、冷却结晶、过滤,在这一系列操作中没有用到的玻璃仪器有( )
| A.烧瓶 | B.酒精灯 | C.漏斗 | D.烧杯 E.玻璃棒 |
(4)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,取A中的溶液,分成两份,并设计了如下实验:
方案①:往第一份试液中加入少量酸性KMnO4溶液,紫红色褪去。
方案②:往第二份试液中加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
上述方案不合理的是______,原因是___________________________________。
(5)能表明的还原性性弱于SO2的现象是________________________________________。
利用 Y 型管与其它仪器组合可以进行许多实验(固定装置略)。分析并回答下列问题: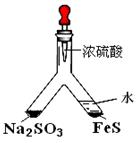
(1)实验目的:验证SO2有氧化性。
将胶头滴管中浓硫酸分别滴入 Y型管的两个支管中,在支管交叉处实验现象为__________________________________;
硫化亚铁处加水的目的是____________________________。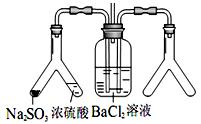
(2)实 验目的:探究 SO2与BaCl2反应产生沉淀的条件。二氧化硫通入氯化钡溶液并不产生沉淀,而通入另一种气体后可以产生白色沉淀。则右侧 Y型管中应放置的药品是____________和___________(必要时可以加热),该沉淀的化学式为________________。
验目的:探究 SO2与BaCl2反应产生沉淀的条件。二氧化硫通入氯化钡溶液并不产生沉淀,而通入另一种气体后可以产生白色沉淀。则右侧 Y型管中应放置的药品是____________和___________(必要时可以加热),该沉淀的化学式为________________。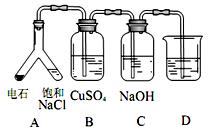
(3)实验目的:探究电石气中的成分。
①装置 A中发生的主要化学反应方程式为:___________________________。
② B装置中出现黑色沉淀,C 装置的作用为__________。
③为验 证电石气的主要成分,D中盛放______________。
证电石气的主要成分,D中盛放______________。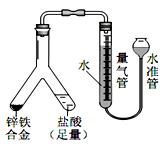
(4)实验目的:锌铁合金中铁含量的测定
①读取量气管中数据时,若发现水准管中的液面低于量气管中液面,应采取的措施是___________________。
②若称得锌铁合金的质量为 0.117g,量气管中初读数为 1. 00mL,末读数为 45.80mL,则合金中铁的含量为_____%(保留2 位小数,已折算标况)。
下表是实验室制备气体的有关内容:
| 编号 |
实验内容 |
实验原理 |
气体发生装置 |
| ①[ |
制备氧气 |
H2O2→O2 |
|
| ② |
制备氨气 |
NH4Cl→NH3 |
|
| ③ |
制 备氯气 备氯气 |
HCl→Cl2 |
(1)上述气体中:从制备过程看,必须选择合适的氧化剂才能实现的是(填气体名称,下同);从反应原理看,明显不同于其他两种气体的是。
(2)根据表中所列实验原理,从下列装置中选择合适的气体发生装置,将其编 号填入上表中的空格中。
号填入上表中的空格中。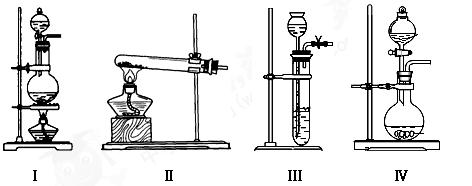
(3)某学习小组设计了如下图实验,将氯气依次通过下列装置以验证氯气的性质: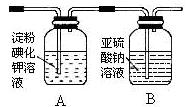
①通入氯气后,A中的现象是,整套实验装置存在的明显缺陷是。
②请你帮该小组同学设计一个实验,证明洗气瓶B中的Na2SO3已被氧化:
(4)若用排空气法收集Cl2,在下边方框内画出气体收集装置图。
(5)若将多余的Cl2用100 mL 1.7mol/L的NaOH溶液完全吸收。对吸收后的溶液进行分析化验,测知其pH等于13 (不考虑反应前后溶液的体积变化),ClO-和ClO3-的物质的量浓度之比为5∶1。则在整个过程中被氧化的氯气的物质的量为 mol。
mol。
某校化学兴趣小组用如下装置图验证NO2的氧化性和NO的还原性。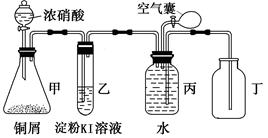
请回答下列问题:
(1)写出甲中反应的离子方程式:;
(2)说明NO2具有氧化性的现象是;
(3)说明NO具有还原性的操作和现象是;
(4)小组一成员对实验设计提出了质疑,他认为乙中的现象不足以证明NO2的氧化性,他的理由是;
经小组讨论,他们设计了以下方案,其中合理的是
A.NO2与HCl气体混合 B.NO2与H2S气体混合 C.NO2通入Na2S溶液中
某校化学兴趣小组用如下装置图验证NO2的氧化性和NO的还原性。
请回答下列问题:
(1)写出甲中反应的离子方程式:;
(2)说明NO2具有氧化性的现象是;
(3)说明NO具有还原性的操作和现象是;
(4)小组一成员对实验设计提出了质疑,他认为乙中的现象不足以证明NO2的氧化性,他的理由是;
经小组讨论,他们设计了以下方案,其中合理的是
A.NO2与HCl气体混合 B.NO2与H2S气体混合 C.NO2通入Na2S溶液中
丁烷的催化裂解可按下列两种方式进行:C4H10 →C2H6 + C2H4;C4H10 → CH4 + C3H6;化学兴趣小组的同学为探究丁烷裂解气中CH4和 C2H6的比例关系,设计实验装置如下图所示 注:CuO能将烃氧化成CO2和H2O;后面的装置已略去。
注:CuO能将烃氧化成CO2和H2O;后面的装置已略去。
请回答下列问题:
(1)如图连接好装置后,需进行的实验操作有①给D、G装置加热;②检查整套装置的气密性;③排尽装置中的空气。这三步操作的先后顺序依次是,
简要说明排空气和证明空气已排尽的方法。
(2)为了调控实验过程中丁烷的气流速度,设置了B装置,操作时应观察来实现实验的要求。
(3)若对E装置中的混合物再按以下流程实验: 分离操作I和II的操作名称分别是:I,II。
分离操作I和II的操作名称分别是:I,II。
(4)假设丁烷完全裂解,且流经各装置中的气体均完全反应,为测定丁烷裂解产物中n(CH4):n(C2H6)的值,本实验中应该准确获取的数据应有(选填下列数据序号)。
① C装置增加的质量② E装置增加的质量③ F装置增加的质量④ G装置增加的质量