某化学研究性学习小组探究Fe3+和SO32-之间发生的反应。
(1)取5mLFeCl3浓溶液于试管中,逐滴加入Na2SO3浓溶液,观察到溶液颜色由黄色变为红棕色,继续加入Na2SO3浓溶液至过量,溶液颜色加深,最终变为红褐色。无气泡产生,无沉淀生成。这种红褐色液体是___________________。
(2)除了观察到以上的现象外,有成员提出了另一种可能:发生氧化还原反应。反应的离子方程式为 。
研究性学习小组设计了两种实验方案证明发生了氧化还原反应。请把实验方案补充完整:
方案一:检验溶液中含有Fe2+证明发生了氧化还原反应
方案二:检验溶液中含有 证明发生了氧化还原反应
实验用品:0.1mol/L BaCl2、3mol/L盐酸、0.1mol/LKMnO4(H+)、氯水、20%KSCN、0.5mol/LKI;试管若干、胶头滴管若干
Ⅰ预处理:将(1)中获得的混合物放在如图装置中处理足够时间。
Ⅱ检验过程
| 操 作 |
现象及结论 |
| 基于方案一: |
|
| 基于方案二: |
|
某氮肥NH4HCO3中混有少量(NH4)2CO3,现采用下列方案测定该氮肥中(NH4)2CO3的质量分数:称取5.7 g上述样品与2.0 mol/L NaOH溶液混合,完全溶解后,低温加热使其充分反应(该温度下铵盐不分解),并使生成的氨气全部被硫酸吸收,测得氨气的质量与所用NaOH溶液体积的关系如图所示:
(1)A点前样品与NaOH反应的离子方程式为__________________________________
(2)为使生成的氨气被硫酸吸收时不发生倒吸,可以选用下列装置中的________。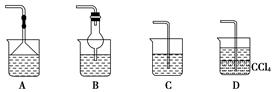
(3)样品中(NH4)2CO3的质量分数是________%(保留一位小数)。
现有铁、碳两种元素组成的合金,某实验小组为了研究该合金的性质并测定该合金中碳的质量分数,设计了如下实验方案和实验装置:
Ⅰ.探究该合金的某些性质:
(1)取a g合金粉末放入蒸馏烧瓶,并加入足量浓硫酸,A、B中均无明显现象,原因是_________________________________________________________________。
(2)点燃酒精灯一段时间后,A中剧烈反应,请写出A中反应的化学方程式:________________________________________。
(3)在盛有BaCl2溶液的C试管中,除了导管口有气泡外,无其他明显现象,若将其分成两份,分别滴加下列溶液,将产生沉淀的化学式填入下表相应的位置。
| 滴加的溶液 |
氯水 |
氨水 |
| 沉淀的化学式 |
Ⅱ.测定样品中碳的质量分数:
(4)装置F的作用是_______________________________________________________。
(5)反应结束后,若U形管E增重m g,则合金中碳的质量分数为________(用含m和a的式子表示)。若没有装置D,会使合金中碳的质量分数______ (填偏高、偏低、无影响)
(6)若将SO2气体通入含有n mol Na2S的溶液中,溶液中出现黄色浑浊,试分析该溶液最多能吸收SO2气体________mol(不考虑溶解的SO2)。
用含少量铁的氧化物的氧化铜制取氯化铜晶体(CuCl2·xH2O)。有如下操作:
已知:在pH为4~5时,Fe3+几乎完全水解而沉淀,而此时Cu2+却几乎不水解。
(1)溶液A中的金属离子有Fe3+、Fe2+、Cu2+。能检验溶液A中Fe2+的试剂为(填编号,下同)
①KMnO4②(NH4)2S③NaOH④KSCN
(2)氧化剂可选用。
①Cl2②KMnO4③HNO3④H2O2
(3)要得到较纯的产品,试剂可选用。
①NaOH②FeO③CuO④Cu(OH)2⑤Cu2(OH)2CO3
(4)欲测定溶液A中的Fe2+的浓度,实验前,首先要配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、药匙、胶头滴管外,还需,下列滴定方式中(夹持部分略去),最合理的是(填序号)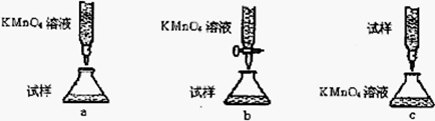
写出滴定反应的离子方程式_____。
(5)为了测定制得的氯化铜晶体(CuCl2·xH2O)中 的值,某兴趣小组设计了两种实验方案:(已知CuCl2的摩尔质量为135g/mol;H2O的摩尔质量为18g/mol)。
的值,某兴趣小组设计了两种实验方案:(已知CuCl2的摩尔质量为135g/mol;H2O的摩尔质量为18g/mol)。
方案一:称取m g晶体灼烧至质量不再减轻为止,冷却、称量所得无水CuCl2的质量为n1 g。
方案二:称取m g晶体溶于水,加入足量氢氧化钠溶液、过滤、沉淀洗涤后用小火加热至质量不再轻为止,冷却,称量所得固体的质量为n2 g。
试评价上述两种实验方案:其中正确的方案是,据此计算得x=(用含m、n1或n2的代数式表示)。
(6)某同学想利用氯化钠设计一套实验装置来电解饱和食盐水,并检验氯气的氧化性和测定所产生的氢气的体积(约8mL)。
试从上图中选用几种必要的仪器,连成一整套装置,各种仪器接口的连接顺序(填编号)是:
A接,接;B接,接;
(7)若装入的饱和食盐水为75mL(氯化钠足量,电解前后溶液体积变化可忽略,假设两极产生的气体全部逸出),当测得氢气为8.4mL(标准状况)时停止通电。将U形管内的溶液倒入烧杯,其pH约为。
(12分)化学是一门以实验为基础的学科,试回答以下问题。
(1)选用装置甲、戊制取并收集少量氨气,氨气应从收集装置的(填“长”或“短”)导管进气,写出利用该装置制备氨气的化学方程式。
(2)选用装置乙、丙制备少量一氧化氮气体,乙中塑料板上若放置大理石,则装置乙的作用是,丙中产生NO的离子方程式为。
(3)二氧化氯(ClO2)为A1级消毒剂,某研究小组利用丁装置制备ClO2。
①在烧瓶中放入KClO3和草酸(H2C2O4),然后加入足量的稀硫酸,水浴加热。反应生成ClO2、CO2和一种酸式盐,则该反应中氧化产物与还原产物物质的量之比为。
②温度过高时,二氧化氯的水溶液有可能引起爆炸。在反应开始前将烧杯中的水加热到80℃,然后停止加热,并使其保持在60~80℃之间,丁装置中缺少的一种必需的玻璃仪器名称是。
③将二氧化氯溶液加入到硫化氢溶液中,加入少量的稀盐酸酸化过的氯化钡溶液,发现有白色沉淀生成,该沉淀的化学式为。
(14分)Na2S2O3·5H2O俗称“海波”,常用于脱氧剂、定影剂和还原剂,是无色易溶于水的晶体,不溶于乙醇,在20°C和70°C时的溶解度分别为60.0g和212g, Na2S2O3·5H2O于40~45°C熔化,48°C分解。已知Na2S2O3的稀溶液与BaCl2溶液混合无沉淀生成。下面是Na2S2O3·5H2O的实验室制备及相关性质实验。
制备海波的反应原理:Na2SO3+S Na2S2O3
Na2S2O3
制备海波的流程:
(1)实验开始时用1mL乙醇润湿硫粉的作用是(填字母)。
A.有利于亚硫酸钠与硫黄的充分接触
B.防止亚硫酸钠溶解
C.控制溶液的pH
D.提高产品的纯度
(2)趁热过滤的原因是。
(3)滤液不采用直接蒸发结晶的可能原因是。
(4)抽滤过程中需要洗涤产品晶体,下列液体最适合的是(填字母)。
A.无水乙醇B.饱和NaCl溶液 C.水D.滤液
(5)为验证产品中含有Na2SO3和Na2SO4,请将以下实验方案补充完整(所需试剂从稀HNO3、稀H2SO4、稀HCl、BaCl2溶液、蒸馏水中选择)。
①取适量产品配成稀溶液,,生成白色沉淀;
②,若沉淀未完全溶解,且有刺激性气味气体产生,则可确定产品中含有Na2SO3和Na2SO4。该流程制得的Na2S2O3·5H2O粗产品可通过方法提纯。