(14分)Na2S2O3·5H2O俗称“海波”,常用于脱氧剂、定影剂和还原剂,是无色易溶于水的晶体,不溶于乙醇,在20°C和70°C时的溶解度分别为60.0g和212g, Na2S2O3·5H2O于40~45°C熔化,48°C分解。已知Na2S2O3的稀溶液与BaCl2溶液混合无沉淀生成。下面是Na2S2O3·5H2O的实验室制备及相关性质实验。
制备海波的反应原理:Na2SO3+S Na2S2O3
Na2S2O3
制备海波的流程:
(1)实验开始时用1mL乙醇润湿硫粉的作用是 (填字母)。
A.有利于亚硫酸钠与硫黄的充分接触
B.防止亚硫酸钠溶解
C.控制溶液的pH
D.提高产品的纯度
(2)趁热过滤的原因是 。
(3)滤液不采用直接蒸发结晶的可能原因是 。
(4)抽滤过程中需要洗涤产品晶体,下列液体最适合的是 (填字母)。
A.无水乙醇 B.饱和NaCl溶液 C.水 D.滤液
(5)为验证产品中含有Na2SO3和Na2SO4,请将以下实验方案补充完整(所需试剂从稀HNO3、稀H2SO4、稀HCl、BaCl2溶液、蒸馏水中选择)。
①取适量产品配成稀溶液, ,生成白色沉淀;
② ,若沉淀未完全溶解,且有刺激性气味气体产生,则可确定产品中含有Na2SO3和Na2SO4。该流程制得的Na2S2O3·5H2O粗产品可通过 方法提纯。
某酸性工业废水中含有K2Cr2O7。光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+。某课题组研究发现,少量铁明矾[Al2Fe(SO4)4 ·4H2O]即可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
(1)在25°C下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,作对比实验,完成以下实验设计表(表中不要留空格)。
| 实验编号 |
初始pH |
废水样品体积/mL |
草酸溶液体积/mL |
蒸馏水体积/mL |
| ① |
4 |
B= |
10 |
30 |
| ② |
5 |
60 |
10 |
d= |
| ③ |
a= |
60 |
c= |
20 |
测得实验①和②溶液中的Cr2O72-浓度随时间变化关系如图所示。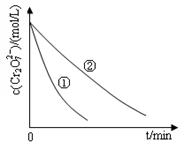
(2)上述反应后草酸被氧化为(填化学式);
(3)实验①和②的结果表明_______________________________;
(4)该课题组对铁明矾[Al2Fe(SO4)4 ·4H2O]中起催化作用的成分提出如下假设,请你完成假设二和假设三:
假设一:Fe2+起催化作用;假设二:;假设三:;……
(5)请你设计实验验证上述假设一,完成下表中内容。(除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4·Al2(SO4)3·24H2O、Al2(SO4)3等。(溶液中Cr2O72-的浓度可用仪器测定)
| 实验方案(不要求写具体操作过程) |
预期实验结果和结论 |
取_______________________________代替实验①中的铁明矾,控制其他反应条件与实验①相同,进行对比实验 |
反应进行相同时间后, 若溶液中的Cr2O72-浓度____________________________则假设一成立; 若溶液中的Cr2O72-浓度____________________________则假设一不成立; |
(6)铁明矾长期存放,其中的亚铁离子可能会变质。为测定铁明矾中亚铁离子的质量分数。取5.6g铁明矾晶体,将其配制为100ml的溶液,取出20ml置于锥形瓶中。用0.01mol/L的标准KMnO4溶液进行滴定(还原产物为Mn2+),平行做4组实验,得出如下表数值。
| 组数 |
1 |
2 |
3 |
4 |
| 消耗V(KMnO4)/ml |
20.04 |
20.00 |
18.90 |
19.96 |
请计算铁明矾中亚铁离子的质量分数:。若滴定结束后读数时仰视,测定结果(填“偏大”“不影响”或“偏小”)
Na2S2O3是重要的化工原料,易溶于水。在中性或碱性环境中稳定。
I.制备Na2S2O3•5H2O反应原理:Na2SO3(aq)+S(s) Na2S2O3(aq)
Na2S2O3(aq)
实验步骤:
①称取15g Na2SO3加入圆底烧瓶中,再加入80ml蒸馏水。另取5g研细的硫粉,用3ml乙醇润湿,加入上述溶液中。
②安装实验装置(如图所示,部分加持装置略去),水浴加热,微沸60分钟。
③趁热过滤,将滤液水浴加热浓缩,冷却析出Na2S2O3•5H2O,经过滤,洗涤,干燥,得到产品。
回答问题:
(1)仪器a的名称是,其作用是。
(2)产品中除了有未反应的Na2SO3外,最可能存在的无机杂质是,检验是否存在该杂质的方法是。
(3)该实验一般控制在碱性环境下进行,否则产品发黄,用离子方程式表示其原因:。
II.测定产品纯度
准确称取Wg产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.1000 mol•L‾1碘的标准溶液滴定,滴定至终点时,消耗标准溶液的体积为18.10 mL。
反应原理为:2S2O32‾+I2=S4O62-+2I‾
(4)滴定至终点时,溶液颜色的变化:。
(5)产品的纯度为(设Na2S2O3•5H2O相对分子质量为M)。
III.Na2S2O3的应用
(6)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO42‾,常用作脱氧剂,该反应的离子方程式为。
下图虚线框中的装置可用来检验浓硫酸与木炭粉在加热条件下反应产生的所有气体产物,填写下列空白:
(1)写出木炭粉与浓硫酸反应的化学方程式;
(2)如果按装置中三部分仪器的连接顺序进行实验。
i.装置①出现现象说明有生成;
ii.装置②中前一瓶品红溶液褪色,说明有生成;
iii.能检验出最后一种产物的现象是;
(3)如果将仪器的连接顺序变为①、③、②,则可以检出的物质是;不能确定的物质是;
(4)若将①、②、③装置拆除,替换装置④进行实验。
装置④中溶液颜色变浅绿色, 其反应的离子方程式是 ;
反应后往④中溶液加入氯化钡溶液,反应的离子方程式是;
(5)若④中的氯化铁溶液含有少量的亚铁离子,为检验少量亚铁离子的存在,可选用的试剂是 。
| A.KSCN溶液 | B.稀盐酸 | C.KMnO4溶液 | D.NaOH溶液 |
某同学设计实验证明铜与浓硫酸能发生反应,并检验生成气体的性质,如图所示,在试管里加入2mL浓硫酸,用带导管和一个小孔的胶管塞紧,从孔中插入一根铜丝,加热,把放出的气体依次通入品红溶液和石蕊溶液中。
请回答下列问题:
(1)写出铜与浓硫酸反应的化学方程式,标出电子转移的数目及方向:。
(2)试管a、b分别检验生成气体的性质,写出观察到的现象及其作用。
试管a中的现象是 ,
作用是 。
试管b中的现象是 ,
作用是 。
(3)装置中浸碱棉团的作用是 。
(4)如图将铜丝改为可抽动的铜丝符合化学实验绿色化的原因是。
要除去下表所列有机物中的杂质(括号内为杂质),从(Ⅰ)中选择适宜的试剂,从(Ⅱ)中选择分离提纯的方法,用序号填入表中。
(1)试剂:a.浓硫酸 b.氢氧化钠溶液 c.生石灰 d.碳酸钠溶液 e.水 f.浓溴水
(2)方法:A.过滤 B.分液 C.蒸馏
| 要提纯的物质 (杂质) |
溴乙烷(乙醇) |
乙醇(水) |
乙醇(乙酸) |
溴苯(溴) |
苯(苯酚) |
| (1)选用试剂 |
|||||
| (2)分离方法 |
(3)以上采用的操作中,B使用的主要玻璃仪器是____________________________。