某同学探究同周期主族元素性质递变规律时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验方案”与“实验现象”前后不一定是对应关系):
| 实验步骤 |
实验现象 |
| 1.将镁条用砂纸打磨后,放入沸水中;再向溶液中滴加酚酞溶液 |
A. 浮在水面上,熔成小球,做不定向运动,随之消失,溶液变成红色。 |
| 2.向新制得的Na2S溶液中滴加少量新制的氯水 |
B.有气体产生,溶液变成浅红色 |
| 3.将一小块钠放入滴有酚酞溶液的冷水中 |
C.剧烈反应,迅速产生大量无色气体。 |
| 4.将镁条投入稀盐酸中 |
D.反应不十分剧烈,产生无色气体 |
| 5.将铝条投入稀盐酸中 |
E.生成淡黄色沉淀 |
请你帮助该同学整理并完成实验报告。
实验目的:探究同周期主族元素性质递变规律。
(1)实验用品:试剂:金属钠,镁条,铝条,稀盐酸,新制氯水,新制Na2S溶液。
仪器:① ,② ,③ ,试管夹,镊子,小刀,玻璃片,砂纸,酒精灯等。
(2)实验内容:(填写与实验步骤对应的实验现象的编号和离子方程式)
| 实验内容 |
实验现象 |
离子方程式 |
| 1 |
|
|
| 2 |
|
|
| 3 |
|
|
| 4 |
|
|
| 5 |
|
|
(3)若用最高价氧化物的水化物的碱性相对强弱来验证Mg、Al失电子能力的强弱,请你设计实验(实验用品自选,不要求写化学方程式): 。
(4)实验结论: ;
实验室欲配制0.5 mol·L―1的NaOH溶液500 mL,有以下仪器:
①烧杯 ②100 mL量筒 ③1000 mL 容量瓶 ④500 mL 容量瓶 ⑤玻璃棒 ⑥托盘天平(带砝码)⑦药匙。
(1)配制时,必须使用的仪器有 (填代号),还缺少的仪器是 ,该实验中两次用到玻璃棒,其作用分别是_________、 。
(2)使用容量瓶前必须进行的一步操作是 。
(3)配制时,一般可分为以下几个步骤:①称量 ②计算 ③溶解 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却,其正确的操作顺序是。
50ml 0.5mol·L-1的盐酸与50ml 0.55mol·L-1的NaOH 溶液在下图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。
请回答下列问题: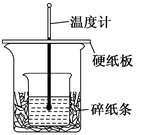
(l)从实验装置上看,由图可知该装置有不妥之处,应如何改正?。
(2)烧杯间填满碎纸条的作用是。
(3)如果不盖硬纸板,求得的中和热数值(填“偏大”“偏小”“无影响”)。
(4)实验中改用 60 mL 0.50 mol· L-1的盐酸跟 50mL 0.55 mol· L-1的 NaOH溶液进行反应,与上述实验相比,所放出的热量(填“相等”或“不相等”),所求中和热(填“相等”或“不相等”)。
(5)用相同浓度和相同体积的氨水代替NaOH溶液进行上述实验,测得中和热的数值会(填“偏大”“偏小”“无影响”);
简述理由。
下图为实验室制取纯净、干燥的Cl2,并进行检验Cl2性质实验的装置。其中E瓶中放有干燥红色布条;F中为铜网,F右端出气管口附近放有脱脂棉。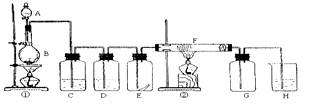
试回答:
(1)A试剂为, B中反应的离子方程式为;
(2)C试剂为 ;D试剂作用为 ;
(3)E中干燥红色布条 (填“褪色”或“不褪色”);
(4)F管中现象 ,脱脂棉的作用是 ;
(5)H中试剂为 ,其中发生反应的离子方程式为 。
Fe、Cu都是人类较早使用的金属,某校化学研究性学习小组的同学运用实验的手段研究Fe、Cu以及化合物的相关性质。请你参与研究并回答下列问题:
(1)甲同学完成了Fe、Cu分别与S、Cl2反应的实验,下列物质中不可能为甲同学实验得到的生成物是
| A.FeCl3 | B.FeCl2 | C.CuCl2 | D.FeS |
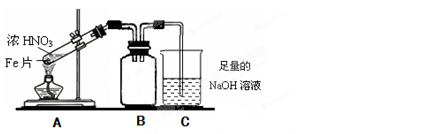
(2)乙同学为验证Fe能和热的浓HNO3反应,设计了如上图所示的实验装置,请说出装置B的作用:。开始加热前(填“有”或“无”)明显现象。
(3)当乙同学实验结束时,铁完全溶解,试管液面上方为无色气体,试管上部为红棕色气体,此时丙同学用所得的溶液进行如下实验和探究:
①在所得的溶液中加入一小块Cu片,结果Cu片先逐渐溶解,并伴随其他现象,反应一段时间后不再溶解。丙同学依据反应现象得出Cu片溶解的原因可能是和过量的HNO3发生反应。他依据的反应现象是;该反应的离子方程式为。你认为Cu片溶解是否还有另一原因,若有请用化学方程式表示其理由:(若无此空不填)
②请你设计实验证明在加入Cu片并反应完全后的溶液中含有Fe2+但不含有Fe3+。说明具体的操作和实验现象。
③丙同学实验结束后加水稀释后得到溶液500mL,假设实验全过程硝酸只被还原成NO和NO2共0.02 mol并测得溶液中Fe2+和Cu2+浓度均为0.02 mol/L,则NO3-的物质的量浓度为
mol/L。生成NO气体的体积为 _________________L(标准状况)。
(4)本次探究实验用掉密度为1.5g·cm-3质量分数为95%的浓硝酸3mL,超出实际参加反应的量其原因有(写出两点):①②
化工生产必须遵循科学原理。请根据下列工艺生产流程回答问题。
(1)某化学课外活动小组以海带为原料获得少量碘,其过程如下图所示:
则:操作①的名称是,操作③使用的试剂(写化学式)。操作②中发生反应的离子方程式为。
(2)海水的综合利用可以制备金属钠和镁,其流程如下图所示:
①上述流程中生成Mg(OH)2沉淀的离子方程式为 。Mg(OH)2沉淀和盐酸反应的离子方程式为。
②实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明这三种情况下使用玻璃棒的作用:
溶解时:____________;过滤时:____________;蒸发时:______________。
③工业上把电解饱和食盐水称为“氯碱工业”。请你完成电解饱和食盐水的化学方程式()NaCl+()H2O ()NaOH+H2↑+()()。
()NaOH+H2↑+()()。