Fe、Cu都是人类较早使用的金属,某校化学研究性学习小组的同学运用实验的手段研究Fe、Cu以及化合物的相关性质。请你参与研究并回答下列问题:
(1)甲同学完成了Fe、Cu分别与S、Cl2反应的实验,下列物质中不可能为甲同学实验得到的生成物是
| A.FeCl3 | B.FeCl2 | C.CuCl2 | D.FeS |
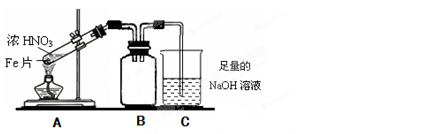
(2)乙同学为验证Fe能和热的浓HNO3反应,设计了如上图所示的实验装置,请说出装置B的作用: 。开始加热前 (填“有”或“无”)明显现象。
(3)当乙同学实验结束时,铁完全溶解,试管液面上方为无色气体,试管上部为红棕色气体,此时丙同学用所得的溶液进行如下实验和探究:
①在所得的溶液中加入一小块Cu片,结果Cu片先逐渐溶解,并伴随其他现象,反应一段时间后不再溶解。丙同学依据反应现象得出Cu片溶解的原因可能是和过量的HNO3发生反应。他依据的反应现象是 ;该反应的离子方程式为 。你认为Cu片溶解是否还有另一原因,若有请用化学方程式表示其理由: (若无此空不填)
②请你设计实验证明在加入Cu片并反应完全后的溶液中含有Fe2+但不含有Fe3+。说明具体的操作和实验现象 。
③丙同学实验结束后加水稀释后得到溶液500mL,假设实验全过程硝酸只被还原成NO和NO2共0.02 mol并测得溶液中Fe2+和Cu2+浓度均为0.02 mol/L,则NO3-的物质的量浓度为
mol/L。生成NO气体的体积为 _________________L(标准状况)。
(4)本次探究实验用掉密度为1.5g·cm-3质量分数为95%的浓硝酸3mL,超出实际参加反应的量其原因有(写出两点):① ②
某校学生课外活动小组的同学设计下图所示实验装置,用来验证一氧化碳具有还原性,回答下列问题:
(1)写出装置A中所发生反应的离子方程式:__________________________________。
(2)装置B中的试剂是饱和 溶液,其作用是_______________________。
溶液,其作用是_______________________。
(3)若实验中没有装置C,使装置B与装置D直接相连,会对实验造成的影响是____
___________________________________________________________________________。
(4)装置D中反应的化学方程式为___________________________________________。
(5)根据实验中的_____________________________________________________现象,
可证明CO具有还原性,有关反应的化学方程式是________________________________。
(6)若要根据装置F中澄清石灰水变浑浊的现象确认一氧化碳具有还原性,应在上图装置_________与________之间连接下图中的__________装置(填序号)。
(1)应用托盘天平称取 晶体_______g。
晶体_______g。
(2)若在称量样品时,药品放在天平右盘上,砝码放在天平左盘上(1g以下使用游码),天平平衡时,实际称量的 晶体是__________g。
晶体是__________g。
(3)本实验用到的主要仪器有:托盘天平、量筒、烧杯、玻璃棒、________、________。
(4)以下情况会使所配溶液的浓度产生何种影响(填“偏高”、“偏低”、“不变”。):
a.溶解晶体用的烧杯和玻璃棒未洗涤。____________
b.定容时俯视刻度线。____________
c.所用 晶体已失去部分结晶水。____________
晶体已失去部分结晶水。____________
(5)若 晶体中混有少量
晶体中混有少量 固体,且用所配制的
固体,且用所配制的 溶液与盐酸反应来测定某盐酸的物质的量浓度,所测盐酸的浓度会________。(填“偏高”、“偏低”、“不变”。)
溶液与盐酸反应来测定某盐酸的物质的量浓度,所测盐酸的浓度会________。(填“偏高”、“偏低”、“不变”。)
实验室需用 晶体配制
晶体配制 的
的 溶液,请回答下列问题。
溶液,请回答下列问题。
(1)应用托盘天平称取 晶体_______g。
晶体_______g。
(2)若在称量样品时,药品放在天平右盘上,砝码放在天平左盘上(1g以下使用游码),天平平衡时,实际称量的 晶体是__________g。
晶体是__________g。
(3)本实验用到的主要仪器有:托盘天平、量筒、烧杯、玻璃棒、________、________。
(4)以下情况会使所配溶液的浓度产生何种影响(填“偏高”、“偏低”、“不变”。):
a.溶解晶体用的烧杯和玻璃棒未洗涤。____________
b.定容时俯视刻度线。____________
c.所用 晶体已失去部分结晶水。____________
晶体已失去部分结晶水。____________
(5)若 晶体中混有少量
晶体中混有少量 固体,且用所配制的
固体,且用所配制的 溶液与盐酸反应来测定某盐酸的物质的量浓度,所测盐酸的浓度会________。(填“偏高”、“偏低”、“不变”。)
溶液与盐酸反应来测定某盐酸的物质的量浓度,所测盐酸的浓度会________。(填“偏高”、“偏低”、“不变”。)
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液。
已知①无水氯化钙可与乙醇形成难溶于水的CaCl2·6 C2H50H
②有关有机物的沸点:
| 试剂 |
乙醚 |
乙醇 |
乙酸 |
乙酸乙酯 |
| 沸点/℃ |
34.7 |
78.5 |
118 |
77.1 |
请回答:(1)浓硫酸的作用是;
写出合成乙酸乙酯的化学方程式:
(2)球形干燥管C的作用是。
(3)饱和Na2CO3溶液的作用()
A.中和乙酸和乙醇.
B.中和乙酸并吸收部分乙醇.
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出.
D.加速酯的生成,提高其产率.
(4)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,
分离出;再加入(此空从下列选项中选择),然后进行蒸馏,收集77℃
左右的馏分,以得较纯净的乙酸乙酯。
A.五氧化二磷 B.碱石灰 C.无水硫酸钠 D.生石灰
为了检验和除去下表中的各种所含的杂质(括号里的物质),请从(I)中选出适当的
检验试剂,从(II)中选出适当的除杂试剂,将所选的答案的序号填入相应的空格内。
| 物质 |
检验试剂 |
除杂试剂 |
| 甲烷(乙烯) |
||
| 酒 精(水) |
(I)检验的试剂:
| A.无水硫酸铜 | B.酸性高锰酸钾溶液 | C.盐酸 | D.氢氧化钠溶液 |
(II)除杂试剂:a.硫酸 b.乙酸 c.新制的生石灰 d.溴水
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液。
已知①无水氯化钙可与乙醇形成难溶于水的CaCl2·6 C2H50H
②有关有机物的沸点:
| 试剂 |
乙醚 |
乙醇 |
乙酸 |
乙酸乙酯 |
| 沸点/℃ |
34.7 |
78.5 |
118 |
77.1 |
请回答:(1)浓硫酸的作用是 ;
写出合成乙酸乙酯的化学方程式:
(2)球形干燥管C的作用是 。
(3)饱和Na2CO3溶液的作用()
A.中和乙酸和乙醇.
B.中和乙酸并吸收部分乙醇.
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出.
D.加速酯的生成,提高其产率.
(4)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,
分离出 ;再加入(此空从下列选项中选择) ,然后进行蒸馏,收集77℃
左右的馏分,以得较纯净的乙酸乙酯。
A.五氧化二磷 B.碱石灰 C.无水硫酸钠 D.生石灰