化工生产必须遵循科学原理。请根据下列工艺生产流程回答问题。
(1)某化学课外活动小组以海带为原料获得少量碘,其过程如下图所示:
则:操作①的名称是 ,操作③使用的试剂(写化学式) 。操作②中发生反应的离子方程式为 。
(2)海水的综合利用可以制备金属钠和镁,其流程如下图所示:
①上述流程中生成Mg(OH)2沉淀的离子方程式为 。Mg(OH)2沉淀和盐酸反应的离子方程式为 。
②实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明这三种情况下使用玻璃棒的作用:
溶解时:____________;过滤时:____________;蒸发时:______________。
③工业上把电解饱和食盐水称为“氯碱工业”。请你完成电解饱和食盐水的化学方程式( )NaCl+( )H2O  ( )NaOH+H2↑+( )( )。
( )NaOH+H2↑+( )( )。
如图学习小组甲、乙所示进行乙醇的催化氧化实验,试管A中盛有无水乙醇,B中装有Cu或CuO(用石棉绒作载体),C中装的是蒸馏水。请回答下列问题: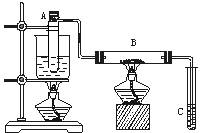

甲乙
⑴甲中B内放置的是; 乙中B内放置的是。
乙向试管A中鼓入空气的目的是_____________________。
⑵甲乙装置中A试管为什么都要水域加热:。
⑶甲中玻璃管中可观察到的现象是_____________________;
甲和乙中反应的化学方程式分别是_______________________;
。
⑷在实验过程中试管C导管口有气泡冒出,从液面逸出的气体的主要成分是_______________________。
关于“电解氯化铜溶液时的pH变化”问题,化学界有以下两种不同的观点:观点一:“理论派”认为电解氯化铜溶液后溶液的pH升高。观点二:“实验派”经过反复、多次、精确的实验测定,证明电解氯化铜溶液时pH值的变化如右图曲线关系。请回答下列问题:
①电解前氯化铜溶液的pH值处于A点位置的原因是:(用离子方程式说明)。
②“理论派”所持观点的理论依据是:。
③“实验派”的实验结论是 ,他们所述“精确实验”是通过
确定的。
④你持何种观点?你所持观点的理由是(从化学原理加以简述)。
某固体混合物可能含有
、
、
、
和
,将该混合物进行如下实验,根据所给实验现象完成表格(对于可能确定的物质在相应位置写化学式,暂不能确定的物质在相应位置填"无")。
| 肯定存在的物质 |
肯定不存在的物质 |
理由 |
| 1. |
(1)将少许固体放入水中得到无色溶液和白色沉淀。
|
| 2. |
(3)取白色沉淀加入稀盐酸,沉淀完全溶解并放出气体。
|
| 3. |
(4)通过上述实验仍无法确定的物质是 |
某课外小组利用
还原黄色的
粉末测定
的相对原子质量,下图是测定装置的示意图,
中的试剂是盐酸。
请回答下列问题。
(1)仪器中装入的试剂:
、
、
;
(2)连接好装置后应首先;
(3)"加热反应管
"和"从
瓶逐滴滴加液体"这两步操作应该先进行的是:。在这两步之间还应进行的操作是;
(4)反应过程中
管逸气体是,其处理方法是:_。
(5)从实验中测得了下列数据
①空
管的质量
②
管和
的总质量
③反应后
管和
粉的总质量
(冷却到室温称量)
④反应前
管及内盛物的总质量
⑤反应后
管及内盛物的总质量
由以上数据可以列出计算
的相对原子质量的两个不同计算式(除
外,其他涉及的元素的相对原子质量均为已知):
计算式1:
=;计算式2:
=。
某化学研究性学习小组拟测定食醋的总酸量(g/100mL),请你参与该小组的实验并回答相关问题。
实验目的
测定食醋的总酸量
实验原理
中和滴定
实验用品
蒸馏水,市售食用白醋样品500mL(商标注明总酸量:3.50g/100mL~5.00g /100mL),
0.1000mol/LNaOH标准溶液;
100mL容量瓶,10ml移液管,碱式滴定管,铁架台,滴定管夹,锥形瓶,烧杯,酸碱指示剂(可供选用的有:甲基橙,酚酞,石蕊)。
实验步骤
① 配制并移取待测食醋溶液
用10mL移液管吸取10mL市售白醋样品置于100mL容量瓶中,用处理过的蒸馏水稀释至刻度线,摇匀后用酸式滴定管取待测食醋溶液20mL,并移至锥形瓶中。
② 盛装标准NaOH溶液
将碱式滴定管洗净后,用NaOH标准溶液润洗3次,然后加入NaOH标准溶液,排除尖嘴部分气泡后,使液面位于“0”刻度或“0”度以下。静置,读取数据并记录为NaOH标准溶液体积的初读数。
③ 滴定
往盛有待测食醋溶液的锥形瓶中滴加某酸碱指示计2~3滴,滴定至终点。记录NaOH的终读数。重复滴定3次。
数据记录
| 滴定次数 实验数据 |
1 |
2 |
3 |
4 |
| V(样品)/mL |
20.00 |
20.00 |
20.00 |
20.00 |
| V (NaOH)始/mL |
0.00 |
0.20 |
0.10 |
0.10 |
| V (NaOH)终/mL |
14.98 |
15.20 |
15.12 |
16.24 |
问题与思考
⑴ 步骤①中中还需补充的仪器有▲。蒸馏水的处理方法是▲。
⑵ 步骤③中你选择的酸碱指示剂是▲,理由是▲。
⑶ 若用深色食醋进行实验,为准确判断滴定终点,可采取的措施是▲。
⑷ 样品总酸量=▲ g/100mL。