某校学生小组为探究乙酸、碳酸和苯酚的酸性强弱并证明乙酸为弱酸,进行下述实验.
探究乙酸、碳酸和苯酚的酸性强弱关系该校学生设计了下图的实验装置(夹持仪器已略去).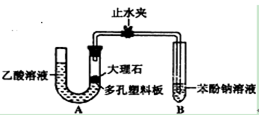
(1)某生检查装置A的气密性时,先关闭止水夹,从左管向U型管内加水,至左管液面高于右管液面,静置一段时间后,若U型管两侧液面差不发生变化,则气密性良好.你认为该生的操作正确与否?_________ (填“正确”或“错误”)大理石与乙酸溶液反应的化学方程式为 _________
(2)装置A中反应产生的气体通入苯酚钠溶液中,实验现象为 _________ 反应的离子方程式为 _________
(3)有学生认为(2)中的实验现象不足以证明碳酸的酸性比苯酚强,理由是乙酸有挥发性,挥发出的乙酸也可以和苯酚钠溶液反应,生成苯酚.改进该装置的方法是 _________ 证明乙酸为弱酸
(4)现有pH=3的乙酸溶液、蒸馏水、石蕊试液及pH试纸,选用适当的仪器和用品,用最简便的实验方法证明乙酸为弱酸 _______ __
(5)在相同温度下,测定相同物质的量浓度
a.NaHCO3溶液 b.Na2CO3溶液 c.CH3COONa溶液 d. ﹣ONa溶液
﹣ONa溶液
的pH,其pH由大到小排列的顺序为 _________ (填溶液编号)
下列有关实验的叙述中,合理的是。
| A.用pH试纸测得氯水的pH为2 |
| B.电解氯化镁溶液在阴极析出金属镁 |
| C.洗涤沉淀时,向漏斗中加蒸馏水至恰好没过沉淀,搅拌并过滤 |
| D.实验室配制氯化亚铁溶液时,可先将氯化亚铁溶解在盐酸中,再加入蒸馏水稀释,最后加入少量铁屑 |
E.向Na2CO3与NaOH的混合溶液中只需加入酚酞试液,即可确认NaOH的存在
F.用苯萃取溴水中的溴,分液时有机层从分液漏斗的下端放出
G.中和滴定实验中,容量瓶和锥形瓶用蒸馏水洗净后即可使用,滴定管和移液管用蒸馏水洗净后,须经干燥或润洗后方可使用
(13分)实验室用下列方法测定某水样中O2的含量。
(1)实验原理
用如图所示装置,使溶解在水中的O2在碱性条件下将Mn2+氧化成MnO(OH)2,反应的离子方程式为。
再用I-将生成的MnO(OH)2再还原为Mn2+,反应的离子方程式为: MnO(OH)2+2I—+4H+=Mn2++I2+3H2O。
然后用Na2S2O3标准溶液滴定生成的I2,反应方程式为: I2+2Na2S2O3=2NaI+Na2S4O6。
(2)实验步骤
①打开止水夹a 和b,从A 处向装置内鼓入过量N2,此操作的目的是;
②用注射器抽取某水样20.00 mL从A 处注入锥形瓶;
③再分别从A 处注入含m mol NaOH溶液及过量的MnSO4 溶液;
④完成上述操作后,关闭a、b,将锥形瓶中溶液充分振荡;
⑤打开止水夹a、b,分别从A 处注人足量NaI溶液及含n mol H2SO4的硫酸溶液;
⑥重复④的操作。
⑦取下锥形瓶,向其中加入2~3滴作指示剂;
⑧用0.005 mol · L—1Na2S2O3滴定至终点。
(3)数据分析
①若滴定过程中消耗的Na2S2O3标准溶液体积为3.90 mL,则此水样中氧(O2)的含量为(单位:mg·L—1)。
②若未用Na2S2O3标准溶液润洗滴定管,则测得水样中O2的含量将(填“偏大”、“偏小”或“不变”)。
③实验要求加入适量的H2SO4使溶液接近中性,其原因是。
某课外活动小组利用如下左图装置进行乙醇的催化氧化实验并制取乙醛(试管丙中用水吸收产物),图中铁架台等装置已略去。实验时,先加热玻璃管中的铜丝,约lmin后鼓入空气。请填写下列空白: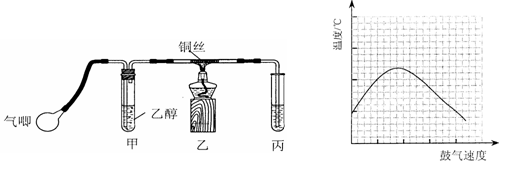
(1)检验乙醛的试剂是;
| A.银氨溶液 | B.碳酸氢钠溶液 | C.新制氢氧化铜悬浊液 | D.氧化铜 |
(2)乙醇发生催化氧化的化学反应方程式为;
(3)实验时,常常将甲装置浸在70℃~80℃的水浴中,目的是 ___ ,由于装置设计上的缺陷,实验进行时可能会 _____。
(4)反应发生后,移去酒精灯,利用反应自身放出的热量可维持反应继续进行。进一步研究表明,鼓气速度与反应体系的温度关系曲线如上右图所示。
试解释鼓气速度过快,反应体系温度反而下降的原因:,该实验中“鼓气速度”这一变量你认为可用来估量;
(5)该课外活动小组偶然发现向溴水中加入乙醛溶液,溴水褪色。该同学为解释上述现象,提出两种猜想:①溴水将乙醛氧化为乙酸;②溴水与乙醛发生加成反应。请你设计一个简单的实验,探究哪一种猜想正确?
实验制取乙烯时,应将乙醇和浓硫酸快速加热到170℃,在140℃时会生成乙醚,温度过高会使部分乙醇跟浓H2SO4反应生成SO2、CO2、水蒸气。
(1)分别写出乙醇跟浓H2SO4反应生成①脱水生成CH2=CH2;②分子间脱水生成CH3CH2-O-CH2CH3;③SO2、CO2、水蒸气的化学方程式
①;
②;
③;
(2)二氧化硫是大气污染物之一,空
气中的二氧化硫随雨水下降形成酸雨。如下图实验装置,对酸雨的形成进行模拟并验证二氧化硫的部分性质,请回答:
①指出图中仪器a的名称:。
②B装置中淡红色纸花的颜色逐渐变褪去,说明SO2有性。
③反应结束后取出C装置中少量液体,滴加紫色石蕊试液后变色。
④实验完毕后。为了使多余的二氧化硫被充分吸收,C装置应如何改进?
(用文字说明)。
在实验室里制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计下列实验图以确认上述混合气体中有C2H4和SO2。回答下列问题:
(1)I、II、III、IV装置可盛放的试剂是
I ;II ;III ;
IV(将下列有关试剂的序号填入空格内)。
| A.品红溶液 | B.NaOH溶液 | C.浓硫酸 | D.酸性KMnO4溶液 |
(2)能说明SO2气体存在的现象是。
(3)使用装置II的目的是。
(4)使用装置III的目的是。
(5)确定含有乙烯的现象是。