某同学设计如图所示装置分别进行探究实验(夹持装置已略去)
| 实验 |
药品 |
制取气体 |
量气管中的液体 |
| ① |
Cu、稀HNO3 |
NO |
H2O |
| ② |
FeCl3溶液、双氧水 |
|
H2O |
| ③ |
Zn、稀H2SO4 |
H2 |
H2O |
| ④ |
NaOH固体、浓氨水 |
NH3 |
|
| ⑤ |
Na2CO3固体、稀H2SO4 |
CO2 |
|
| ⑥ |
镁铝合金、NaOH溶液(足量) |
H2 |
H2O |
请回答下列问题:
(1)本实验应对量气管多次读数,读数时应注意
① ,
② ,③视线与凹液面最低处相平。
(2)实验②收集的气体是 。
(3)若向实验③反应体系中加少量CuSO4溶液,反应速率加快,原因是 。
(4)实验④、⑤中,量气管中的液体分别是 、 。
| A.稀H2SO4 | B.CCl4 | C.饱和Na2CO3溶液 | D.饱和NaHCO3溶液 |
(5)在25℃,101kPa条件下,取 =24.0L/mol。实验⑥数据如下:
=24.0L/mol。实验⑥数据如下:
| 编号 |
镁铝合金质量 |
量气管第一次读数 |
量气管第二次读数 |
| 1 |
1.0g |
20.0mL |
382.2mL |
| 2 |
1.0g |
20.0mL |
360.0mL |
| 3 |
1.0g |
20.0mL |
377.8mL |
根据上述合理数据计算镁铝合金中铝的质量分数 。
四氯化钛(TiCl4)是制取航天航空工业材料——钛合金的重要原料。由钛铁矿(主要成分是FeTiO3)制备TiCl4等产品的一种工艺流程示意图如下: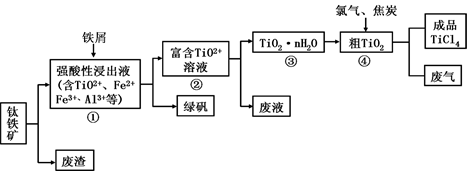
回答下列问题:
(1)往①中加入铁屑至浸出液显紫色,此时溶液仍呈强酸性。该过程中有如下反应发生:
2Fe3+ + Fe ="===" 3Fe2+
2 TiO2+(无色)+ Fe + 4H+="===" 2Ti3+(紫色)+ Fe2++2 H2O
Ti3+(紫色)+ Fe3++ H2O ====TiO2+(无色)+ Fe2++2H+
加入铁屑的作用是。
(2)在②→③工艺过程中需要控制条件以形成TiO2·nH2O溶胶,该溶胶的分散质颗粒直径大小在
范围。
(3)若把③中制得的固体TiO2·nH2O用酸清洗除去其中的Fe(OH)3杂质,还可制得钛白粉。已知25°C时,Ksp[Fe(OH)3] =2.79×10-39,该温度下反应Fe(OH)3+3H+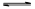 Fe3++3H2O的平衡常数K= 。
Fe3++3H2O的平衡常数K= 。
(4)已知:TiO2(s)+2Cl2(g)====TiCl 4(l)+O2(g) ΔH=+140kJ·mol-1
2C(s)+O2(g)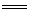 2CO(g) △H=-221kJ·mol-1
2CO(g) △H=-221kJ·mol-1
写出④中TiO2和焦炭、氯气反应生成液态TiCl 4和CO气体的热化学方程式:。
(5)上述工艺具有成本低、可用低品位矿物为原料等优点。依据绿色化学理念,该工艺流程中存在的不足之处是(只要求写出一项 )。
(6)依据表格信息,要精制含少量SiCl 4杂质的TiCl 4,可采用方法。
| TiCl4 |
SiCl4 |
|
| 熔点/℃ |
-25.0 |
-68.8 |
| 沸点/℃ |
136.4 |
57.6 |
利用废铝箔(主要成分为Al、少量的Fe、Si等)既可制取有机合成催化剂AlBr3又可制取净水剂硫酸铝晶体。
I.实验室制取无色的无水AlBr3(熔点:97.5℃,沸点:263.3℃~265℃,在空气中AlBr3遇水蒸气易发生水解)可用如图所示装置,主要实验步骤如下: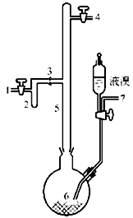
步骤l.将铝箔剪碎,用CCl4浸泡片刻,干燥,然后投入到烧瓶6中。
步骤2.从导管口7导入氮气,同时打开导管口l和4排出空气,一段时间后关闭导管口7和1;导管口4接装有P2O5的干燥管。
步骤3.从滴液漏斗滴入一定量的液溴于烧瓶6中,并保证烧瓶6中铝过剩。
步骤4.加热烧瓶6,回流一定时间。
步骤5.将氮气的流动方向改为从导管口4到导管口l。将装有P2O5的干燥管与导管口1连接,将烧瓶6加热至270℃左右,使AlBr3蒸馏进入收集器2。
步骤6.蒸馏完毕时,在继续通入氮气的情况下,将收集器2从3处拆下,并立即封闭3处。
(1)步骤l中,铝箔用CCl4浸泡的目的是______________________________。
(2)步骤2操作中,通氮气的目的是______________________________。
(3)步骤3中,该实验要保证烧瓶中铝箔过剩,其目的是_______________________。
(4)步骤4依据何种现象判断可以停止回流操作_______________________________。
(5)步骤5需打开导管口l和4,并从4通入N2的目的是_______________________。
II.某课外小组的同学拟用废铝箔制取硫酸铝晶体,已知铝的物种类别与溶液pH关系如图所示,实验中可选用的试剂:处理过的铝箔;2.0mol·L-1NaOH溶液:2.0 mol·L-1硫酸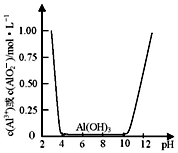
(6)由铝箔制备硫酸铝晶体的实验步骤依次为:
①称取一定质量的铝箔于烧杯中,分次加入2.0 mol•L-1NaOH溶液,加热至不再产生气泡为止。
②过滤
③_________________________________;
④过滤、洗涤沉淀;
⑤向沉淀中不断加入2.0mol·L-1硫酸,至恰好溶解;
⑥_______________;
⑦冷却结晶;
⑧过滤、洗涤、干燥。
亚氯酸钠(NaClO2)是一种高效氧化剂、漂白剂。已知 NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,高于38℃时析出固体是无水NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。利用下图所示装置制备亚氯酸钠。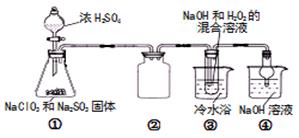
完成下列填空:
(1)组装好仪器后,检查装置气密性的操作是。
(2)装置①中用NaClO3、Na2SO3和浓H2SO4反应制得ClO2,写出该反应的化学方程式,装置③发生反应的离子方程式为。
(3)装置③反应后的溶液中还含有少量NaOH杂质,从该溶液获得无水NaClO2晶体的操作步骤为:①50℃左右蒸发结晶;②;③用50℃左右的温水洗涤;④低于60℃干燥,得到成品。步骤③中用50℃左右的温水洗涤的原因是。
(4)①准确称取所得亚氯酸钠样品10.0g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应。将所得混合液配成250mL待测溶液。
②取25.00mL待测液,用2.0 mol·L-1Na2S2O3标准液滴定(I2 +2S2O32-→2I-+S4O62-),以淀粉溶液做指示剂,达到滴定终点时的现象为。重复滴定3次,测得数据如下表所示。则该样品中NaClO2的质量分数为。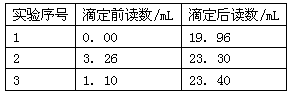
(5)在实验过程中,下列操作会使实验结果偏高的是
a.读取标准液体积时,开始时平视读数,结束时仰视读数
b.配制250mL待测液时,定容后摇匀发现液面下降,又补加水重新达到刻度线
c.盛装待测液的滴定管注液前未用待测溶液润洗
d.盛装标准液的滴定管尖嘴处滴定前有气泡,滴定终点时气泡消失
(6)已知常温下Ka(HClO2)=1×10-2、 Ka(CH3COOH)=1.75×10-5,则0.1mol/L的HClO2溶液与0.05mol/L的NaOH溶液等体积混合所得溶液中各离子浓度由大到小的顺序为。
现有下列仪器或用品:①铁架台(含铁圈、各种铁夹);②锥形瓶;③滴定管(酸式与碱式);④烧杯(若干个);⑤玻璃棒;⑥天平(含砝码);⑦滤纸;⑧量筒;⑨漏斗。有下列药品:①NaOH固体;②0.1000mol/L的标准NaOH溶液;③未知浓度的盐酸;④Na2CO3溶液。试回答以下问题。
(1)做酸碱中和滴定时,还缺少的试剂是。
(2)小明在做“研究温度对反应速率的影响”实验时,他往两支试管均加入4mL 0.01mol/L的KMnO4酸性溶液和2mL 0.1mol/L H2C2O4(乙二酸)溶液,振荡,A试管置于热水中, B试管置于冷水中,记录溶液褪色所需的时间。褪色所需时间tAtB(填“>”、“=”或“<”)。
写出该反应的离子方程式。
(3)实验室有瓶混有泥沙的乙二酸样品,小明利用这个反应的原理来测定其含量,具体操作为:
①配制250 mL溶液:准确称量5.000g乙二酸样品,配成250mL溶液。
②滴定:准确量取25.00 mL所配溶液于锥形瓶中,加少量酸酸化,将0.1000 mol·L-1 KMnO4溶液装入(填“酸式”或“碱式”)滴定管,进行滴定操作。
在实验中发现,刚滴下少量KMnO4溶液时,溶液紫红色并没有马上退去。将锥形瓶摇动一段时间后,紫红色才慢慢消失;再继续滴加时,紫红色就很快褪色了,可能原因是;
当,说明达到滴定终点。
③计算:重复上述操作2次,记录实验数据如下表。则消耗KMnO4溶液的平均体积为mL,此样品的纯度为。(已知H2C2O4的相对分子质量为90)
| 序号 |
滴定前读数 |
滴定后读数 |
| 1 |
0.00 |
20.01 |
| 2 |
1.00 |
20.99 |
| 3 |
0.00 |
21.10 |
④误差分析:下列操作会导致测定结果偏高的是。
A.未用标准浓度的酸性KMnO4溶液润洗滴定管
B.滴定前锥形瓶有少量水
C.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
D.观察读数时,滴定前仰视,滴定后俯视
水杨酸甲酯又叫冬青油,是一种重要的有机合成原料。某化学小组用水杨酸( )和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率。
)和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率。
实验步骤:
Ⅰ.如图,在三颈烧瓶中加入6.9 g (0.05 mol)水杨酸和24 g(30 mL,0.75 mol)甲醇,向混合物中加入约10 mL甲苯(甲苯与水形成的共沸物,沸点为85℃,该实验中加入甲苯,易将水蒸出),再小心地加入5 mL浓硫酸,摇动混匀,加入1~2粒沸石,组装好实验装置,在85~95℃下恒温加热反应1.5小时:
Ⅱ.待装置冷却后,分离出甲醇,然后转移至分液漏斗,依次用少量水、5%NaHCO3溶液和水洗涤;分出的产物加入少量无水MgSO4固体,过滤得到粗酯;
Ⅲ.将粗酯进行蒸馏,收集221℃~224℃的馏分,得水杨酸甲酯4.5g。
常用物理常数:
| 名称 |
分子量 |
颜色状态 |
相对密度 |
熔点(℃) |
沸点(℃) |
| 水杨酸甲酯 |
152 |
无色液体 |
1.18 |
-8.6 |
224 |
| 水杨酸 |
138 |
白色晶体 |
1.44 |
158 |
210 |
| 甲醇 |
32 |
无色液体 |
0.792 |
-97 |
64.7 |
请根据以上信息回答下列问题:
(1)仪器A的名称是,制备水杨酸甲酯时,最合适的加热方法是。
(2)实验中加入甲苯对合成水杨酸甲酯的作用是。
(3)反应结束后,分离甲醇的操作是。
(4)洗涤操作中,第一次水洗的主要目的是,第二次水洗的主要目的是。
(5)检验产品中是否含有水杨酸的化学方法是。
(6)本实验的产率为___________(保留两位有效数字)。