化学兴趣小组利用中和反应测定某 溶液的浓度,实验过程如下:
(1)配制稀盐酸:取 的浓盐酸,加水稀释成 的稀盐酸。所得稀盐酸中溶质的质量为_____;
(2)常温下,测定 溶液浓度:
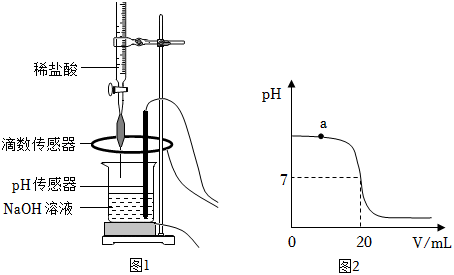
Ⅰ.取 待测 溶液于烧杯中,按图1所示将上述稀盐酸滴入,通过数字化传感器同时测定滴入烧杯内盐酸的体积和烧杯内溶液的 ,得到如图2所示曲线。
Ⅱ.当 溶液与稀盐酸恰好完全反应时,所得溶液的 为_____。经计算,此时已滴入烧杯内的稀盐酸中,所含溶质的质量为 。
设 溶液中溶质的质量为 。
列出比例式__________
求解
答: 溶液中溶质的质量分数为 __________(列式并计算结果);
(3)写出a点对应的溶液中大量存在的分子、离子__________(用化学符号表示)。
图1是某兴趣小组在学习碱的性质时进行的探究活动,请要求回答问题。
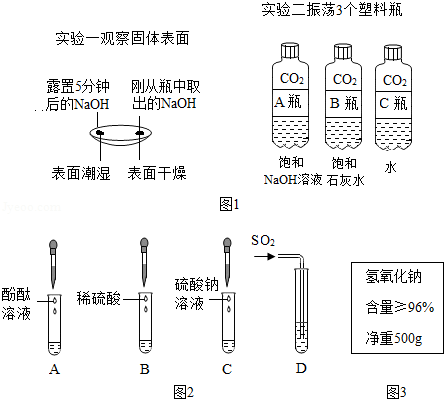
(1)通过分析实验一可知,氢氧化钠会吸收空气中的 。
(2)实验二中观察到3个塑料瓶变瘪的程度为A>B>C,可证明CO2能与NaOH、Ca(OH)2反应,其中C瓶在实验中起 作用。
(3)晓晓查阅资料了解到往Ba(OH)2溶液中滴加或通入下列图2中物质会产生如下现象:A中溶液显红色,B、C、D中均产生白色沉淀。
①写出D试管中反应的化学方程式 。
②不同的碱溶液中都含有OH﹣,所以,碱有一些相似的化学性质。上述关于Ba(OH)2性质的实验不能体现碱的相似性质的是 (填字母序号)
(4)冬冬发现工业上使用的氢氧化钠固体标签如图3所示,于是对其所含杂质进行了探究。
【提出问题】
【提出猜想】
猜想I:查阅资料可知,工业用氢氧化钠可能含有NaCl。
猜想Ⅱ:工业用氢氧化钠可能含有Na2CO3,原因是 (用简洁的文字表述)。
【进行实验】
|
实验步骤 |
实验现象 |
解释或结论 |
|
①取适量固体样品于试管中,加水溶解 |
固体全部溶解 |
/ |
|
②向①所得溶液中滴加过量的 |
一开始无明显变化,一会儿后产生能使澄清石灰水变浑浊的气体 |
样品中含有Na2CO3 |
|
③向②所得溶液中滴加几滴硝酸银溶液 |
产生白色沉淀 |
样品中还含有NaCl.反应的化学方程式为 |
根据如图回答问题。

(1)A中集气瓶内水的作用是 。
(2)B中集气瓶内水位最终约在刻度 处。
(3)C中制备氧气的化学方程式是 。
(4)D中若加入的固体是NH 4NO 3,实验现象是 。
(5)E中探究可燃物燃烧的条件之一是 。
A、B、C、D、E分别表示初中化学常见的五种物质,它们的部分反应和转化关系如图所示("﹣"表示两种物质能发生反应,"→"表示一种物质能转化成另一种物质,且省略部分反应物或生成物及条件),已知其中只有两种物质是氧化物,E是含有三种元素的物质。
(1)若D为水时,且A、B两物质能发生化合反应,请回答:
①写出A、E物质的化学式:A 、E ;
②A与B发生反应的现象为 。
(2)若D为二氧化碳时,请回答:
①写出A、C物质的化学式:A 、C ;
②按照图示所标明的物质关系,写出能生成空气污染物的化学反应方程式 。

如图是氢气和氧气发生反应的微观模拟图,请回答下列问题:
(1)在B图中将相关粒子图形补充完整;
(2)A图所示物质属于 (填物质分类),从微观角度说明理由是 ;
(3)画出比氧元素多一个周期少一个族的元素的原子结构示意图 .

碱式碳酸锌[Zn x(OH) y(CO 3) z]是制备功能材料ZnO的原料,其化学反应表达式为:Zn x(OH) y(CO 3) z  ZnO+CO 2↑+H 2O(x、y、z为正整数)。小金设计了图甲所示装置对碱式碳酸锌的组成进行探究(装置气密性良好,药品足量,实验操作正确):
ZnO+CO 2↑+H 2O(x、y、z为正整数)。小金设计了图甲所示装置对碱式碳酸锌的组成进行探究(装置气密性良好,药品足量,实验操作正确):

(1)图甲中装置B的作用是 。
(2)查阅资料发现,在不同温度条件下充分加热等质量的碱式碳酸锌样品,剩余固体的质量与加热温度的关系如图乙所示。实验中加热时,热分解装置的温度至少要达到 ℃(选填"200"、"300"或"400")。
(3)部分实验步骤为:"……加热前先通入N 2排尽装置内的空气,关闭通入N 2的活塞,……控制一定温度下加热……"。实验过程中可根据 现象判断碱式碳酸锌样品已反应完全。
(4)小金取54.7g碱式碳酸锌样品(不含杂质),放置于热分解装置内,完全反应后测得装置A增重5.4g,装置B增重8.8g。则x:y:z的最简整数比为 。