节日晚会上,小英同学表演魔术“滴水生火”,向包裹着过氧化钠( )的脱脂棉上滴几滴水,脱脂棉着火燃烧,魔术表演成功。同学们很感兴趣,对此进行了探究,请你协助完成以下问题。
[查阅资料]
Ⅰ. ,反应放出热量
Ⅱ. 、 溶液显中性, 溶液显碱性
(1)同学们通过认真分析,从燃烧条件的角度得出了脱脂棉能燃烧的原因 。
(2)将燃烧后的残留固体在烧杯中敞口放置一段时间后,加足量水溶解,无气泡产生,同学们得出结论,残留固体中不含 ;同时有同学认为残留固体中可能含有 ,请用化学方程式说明理由 。
(3)同学们将(2)所得混合液过滤,并设计实验对滤液的溶质成分进行了探究。
|
序号 |
实验操作 |
实验现象 |
实验结论 |
|
i |
取少量滤液于试管中,滴加过量 溶液 |
有白色沉淀产生 |
滤液中溶质为 |
|
ii |
将i所得混合液,静置,往上层清液中滴加2~3滴酚酞溶液 |
|
(4)部分同学认为往滤液中滴加足量稀盐酸,若产生气泡,也能得出同样的结论。你认为是否正确并说明理由 。
某化学实验活动小组的同学为了探究实验室中久置的氢氧化钠固体的成分,进行了有关实验。请你参与他们进行的探究活动:
【提出问题】久置氢氧化钠固体的成分是什么?
【猜想与假设】
猜想Ⅰ:全部是NaOH;猜想Ⅱ:全部是Na2CO3;猜想Ⅲ:。
【实验与探究】
(1)实验如下:
| 实验操作步骤 |
实验现象 |
结论及解释 |
| 步骤一:取少量固体样品于试管中,加蒸馏水完全溶解,然后加入足量的稀盐酸。 |
实验过程中始终没有气泡产生。 |
则证明猜想成立。 |
| 步骤二:另取少量固体样品于试管中,加蒸馏水完全溶解,然后滴加氯化钡溶液。 |
实验过程中产生。 |
则证明猜想Ⅱ或Ⅲ成立。 |
(2)为了进一步的验证猜想结果,小明同学提出如下实验方案:继续步骤二的实验,过滤,然后向滤液中滴加无色酚酞试液,若酚酞变红,则猜想Ⅲ成立;若酚酞不变红,则猜想Ⅱ成立。
小华同学立即对小明同学的方案提出了质疑,通过查阅资料知道,氯化钡溶液呈中性,不能使无色酚酞试液变红,但碳酸钠溶液呈性(填“酸”或“碱”),能使酚酞变红,因此他认为该方案的操作步骤中应该改进的是。
【反思与交流】久置的固体氢氧化钠变质的原因是(用化学方程式表示)。
电池是日常必备用品之一,但它也是环境污染的一个重要来源。下面是某兴趣小组利用废旧锌锰干电池作为原料,并进行相关探究的过程。
【知识储备】
(1)锌锰电池的构造和组成(见图)。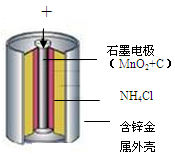
(2)结晶水合物的特殊性质:在逐步升高温度条件下,
结晶水合物能失去部分或者全部结晶水,如蓝色的胆矾
晶体(CuSO4 •5H2O)受热时可失去结晶水变为白色的无
水硫酸铜粉末(CuSO4)。
(Ⅰ)制备皓矾晶体(ZnSO4•xH2O)
小组同学参观了某回收废旧锌锰电池的工厂,其回收工艺流程如图: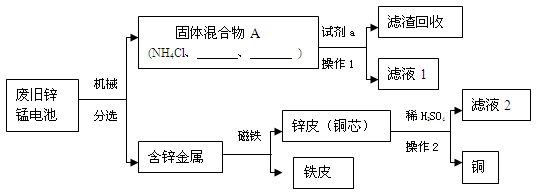
将滤液2蒸发浓缩、冷却结晶可得到皓矾晶体(ZnSO4•xH2O),蒸发时要用要用玻璃棒不断搅拌,目的是防止引起液滴飞溅。
(Ⅱ)兴趣拓展——回收二氧化锰
实验(Ⅰ)中部分步骤可回收较纯净的二氧化锰固体。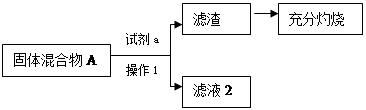
 (1)小王同学认为试剂a为水,你认为能不能实现实验目的?答:。
(1)小王同学认为试剂a为水,你认为能不能实现实验目的?答:。
(2)在空气中充分灼烧的目的是。
(Ⅲ)皓矾晶体中结晶水含量的测定
小组同学将部分皓矾晶体(ZnSO4•xH2O)带回实验室,用下图装置测定晶体中结晶水的含量(图中半透膜可让气体通过又可防止固体粉末进入导管)。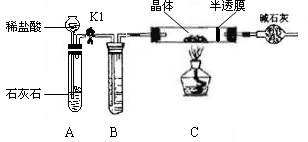
测定方法:称取28.7g晶体置于C装置的硬质玻璃管中,加热至完全失去结晶水:
(ZnSO4•xH2O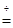 ZnSO4+ xH2O),冷却至常温后,称量玻璃管中固体其质量为16.1g。
ZnSO4+ xH2O),冷却至常温后,称量玻璃管中固体其质量为16.1g。
(1)B中的试剂可从下列物质中选取,你的选择是。
| A.浓硫酸 | B.硝酸银溶液 | C.饱和碳酸钠溶液 | D.澄清石灰水 |
(2) 实验过程中若不通入CO2测得的结果将(填“偏大”、 “偏小”或“无影响”)。
(3)根据实验结果,计算皓矾晶体中结晶水的x值为。
某研究性学习小组的同学在一次探究活动中,对一份纯碱样品(含有少量氯化钠)的纯度进行测定,请你参与并回答有关问题。
⑴ 甲同学进行如下操作:
① 组装好如图仪器,并检查___________ ;
② 取6.0g试样放入锥形瓶中,加入少量蒸馏水溶解,并在其他装置中加入相应的药品;
③ 称量盛有新制澄清石灰水的装置C的质量;
④ 打开分液漏斗旋塞滴入盐酸,直到不再产生气泡为止;
⑤ 再次称量装置C 的总质量;
⑥ 计算出样品中碳酸钠的质量分数。
⑵ 上图B装置的作用是______________; D装置的作用是__________________________。
【意外发现】C瓶中石灰水没有变浑浊,同学们感到惊奇并产生了探究的欲望。
【提出猜想】原因猜想:
①是生成的气体中混有盐酸挥发出来的HCl;
②是生成的气体流速太快,与石灰水反应产生了可溶性物质[经查资料分析可溶性物质是Ca(HCO3)2,它能与酸反应生成CO2等物质]。
【实验探究】
甲同学取少量实验后C瓶溶液于试管中,向其中依次滴加足量稀HNO3和AgNO3溶液,无气泡但有沉淀产生。据此判断只有猜想__(填“①”或“②”)成立。
【交流讨论】
对于如何改进实验,乙同学认为:应将盐酸换成稀硫酸,新制的澄清石灰水换成足量NaOH溶液;丙同学认为:应在装置A和B中间插入一个盛有饱和NaHCO3溶液的洗气装置以吸收HCl(CO2不溶于饱和NaHCO3溶液,也不与其反应),并将新制的澄清石灰水换成足量NaOH溶液 。
大家讨论后认为:乙同学的方案可行而丙同学的方案不可行。
【请你评价】
丙同学方案不可行的原因是。
【教师点拨】
即便换成稀硫酸和NaOH溶液,反应前后装置中存在的CO2也会使测定出的样品纯度不准确。
【请你改进】
在上述基础上,你的措施是。
同学们仍称取6.0g试样,用改进完善后的方案重新实验。
【数据处理】
装置C实验前后两次称量的质量差为2.2g,则样品的纯度为_。(列出计算过程)
【实验反思】
若不用上述方法,而用生成沉淀的方法来测定试样中纯碱的质量分数,可选用的试剂是。
(6分)某化学兴趣小组的同学设计了如图所示的装置,探究影响化学反应速率的因素。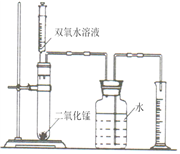
(1) 下图装置中使用注射器的优点是,观察量筒中液体的体积时视线要与。
(2)下面是用上述装置实验时,收集的相关数据:
| 实验 序号 |
H2O2溶液 的浓度/% |
H2O2溶液 的体积/mL |
MnO2的 用量/g |
温度/℃ |
收集O2的体积/mL |
反应所需 的时间/s |
| ① |
5 |
2 |
0.1 |
20 |
4 |
18 |
| ② |
10 |
2 |
0.1 |
20 |
4 |
6 |
| ③ |
30 |
8 |
/ |
40 |
2 |
64 |
| ④ |
30 |
8 |
/ |
60 |
2 |
25 |
由实验①和②对比可知.化学反应速率与 有关;
由实验③和④对比可知.化学反应速率与温度的关系是;
(3)化学反应的实质是构成物质的微观粒子相互碰撞、结合的结果.化学反应速率与微观粒子的概率有关。试从微观角度解释“反应物浓度越大,化学反应速率越快”的原因:
。
(4)发现问题:实验时温度最难控制,反应一段时间后溶液的温度总是比起始时温度高,说明反应
热量。
(5)继续探究:
除了该实验小组探究过的因素以外,你若还有其他影响反应速率的因素及探究方法.请写在下面。若正确.本题另奖励4分,本试卷总分不超过60分。
(10分)某市热电厂使用的燃料是含硫较多的煤.该厂附近一所中学的同学经常闻到空气有异味,且空气能见度差.学习化学后,同学们意识到这有可能是该厂排出的废气超标造成的,于是在老师的指导下做了探究实验,请你填写下列空白,
【提出问题】该厂附近所降雨水是否是酸雨?空气里SO2是否超标呢?
【查阅资料】I.我国关于SO2在风景区、居民区、工厂区的空气质量最高标准分别见下表:
Ⅱ.硫酸钡既不溶于水,也不溶于酸(如不与稀盐酸、稀硝酸等反应).
【设计实验1】第一组同学取刚降到地面的雨水水样,用pH计(测pH的仪器)每隔几分钟测一次pH,其数据如下表所示:
所降雨水(填“是”或“不是”)酸雨。在测定时间内酸雨pH减小的原因可能是__
【设计实验2】第二小组同学设计以下步骤来测定空气中SO2的含量.
(1)用2L的空可乐瓶采集工厂附近的空气样品,采样的具体操作是:
(2)向取回的装有空气样品的可乐瓶中倒入NaOH溶液,盖紧瓶塞后充分振荡,仿照CO2与NaOH溶液的反应,写出SO2与NaOH溶液反应的化学方程式:
(3)加入一定量氧化剂H2O2,使其中Na2SO3完全转化为Na2SO4.向可乐瓶中加入过量的BaCl2溶液.Na2SO4和BaCl2反应的化学方程式为:____
(4)经过过滤、洗涤、烘干,称量固体质量为1.165mg.
计算:1.165mg硫酸钡中硫元素的质量为mg.由质量守恒定律可知,2L空气样品中SO2的质量为mg.
由空气质量标准可得出结论:该厂排放的SO2严重超标.。
【发现新问题】考虑到空气中的各种气体成分,第一组认为第二组同学的SO2的含量偏大,其依据是;你提出的实验改进方案是
【反思与应用】为尽快改善该地区的空气质量,请你提出一条合理化建议: