请阅读下面的材料,回答有关问题。
研究显示:每年排放的二氧化碳近一半存留在大气层,其它被陆地和海洋吸收。人类大量使用煤、石油和天然气等化石燃料,砍伐森林,导致过量的二氧化碳进入海洋,使海洋酸化,表层海水平均pH从8.1下降到7.9。人类给海洋的二氧化碳越多,海水pH越小,吸收二氧化碳的能力就会相对减弱,这样的循环会导致海洋生物链发生变化。
垃圾焚烧发电是生活垃圾处理的有效方式之一,但垃圾焚烧会产生烟尘和有害气体,还会增加二氧化碳的排放,加剧海洋酸化;同时垃圾焚烧需要购买辅助燃料,成本较高。我国烟气处理协同P2G技术很好地解决了这些问题,其主要流程如图所示。
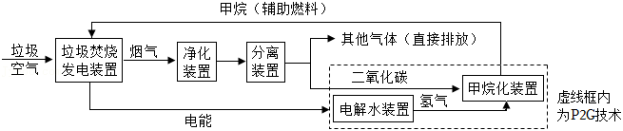
(1)过量的二氧化碳进入海洋,使海洋酸化,发生反应的化学方程式为 。
(2)下列有关海洋酸化的说法不正确的是 (选填字母序号)。
| A. |
海洋酸化是指表层海水呈酸性 |
| B. |
海洋酸化会导致气候变暖加剧 |
| C. |
海洋酸化不会影响海洋生物及其生态系统 |
| D. |
海洋酸化会改变海水中某些离子的浓度 |
(3)流程中“净化装置”的作用是 ,“其它气体”的主要成分有O2和 (填化学式)等气体。
(4)使用P2G技术的优点是 (写一条即可)。
(5)“甲烷化装置”中发生的化学反应是 ,其中X是 (填化学式)。
(6)若用P2G技术处理550kg二氧化碳,使其完全反应。请根据化学方程式计算生成甲烷的质量(写出计算过程)。
【2015年四川省泸州市】过氧化钙晶体﹝CaO2·8H2O﹞较稳定,呈白色,微溶于水,广泛应用于环境杀菌、消毒。以贝壳为原料制备CaO2流程如下:
(1)气体X是CO2,其名称是 ;将过氧化钙晶体与溶液分离的方法是 。
(2)反应Y需控制温度在0~5℃,可将反应容器放在 中,该反应是化合反应,反应产物是CaO2·8H2O,请写出化学方程式 。获得的过氧化钙晶体中常含有Ca(OH)2杂质,原因是 。
(3)CaO2的相对分子质量为 ,过氧化钙晶体﹝CaO2·8H2O﹞中H、O元素的质量比为 。
(4)为测定制得的过氧化钙晶体中CaO2·8H2O的质量分数,设计的实验如下:称取晶体样品50g,加热到220℃充分反应(方程式为2CaO2·8H2O 2CaO+O2↑+16H2O↑,杂质不发生变化),测得生成氧气的质量为3.2g,请计算样品中CaO2·8H2O的质量分数(CaO2·8H2O相对分子质量为216),写出必要的计算过程。
2CaO+O2↑+16H2O↑,杂质不发生变化),测得生成氧气的质量为3.2g,请计算样品中CaO2·8H2O的质量分数(CaO2·8H2O相对分子质量为216),写出必要的计算过程。
【2015年山东省德州市】2015年4月13日,西昌市动物疫病预防控制中心堆放在仓库中浓度为21%的过氧乙酸消毒液发生泄漏。经查阅资料可知:过氧乙酸(化学式为C2H4O3)是无色液体,有强烈刺激性气味,易溶于水、乙醇等,易挥发,与其他酸有相似的化学性质,温度稍高即分解为乙酸、氧气。请回答下列问题:2-1-c-n-j-y
(1)过氧乙酸的物理性质有: (写出两条即可)。
(2)过氧乙酸溶液中存在的阳离子是 (填离子符号)。
(3)过氧乙酸中碳、氢、氧元素的质量比为:
(4)乙酸和过氧乙酸都是无色液体,具有强烈剌激性气味,要把两种液体区别开来,可采用的方法是:________________________________________________________________
【2015年四川省宜宾市】元素X、Y、Z、M是初中常见的四种元素。有关信息如下表:
| 元素 |
有关信息 |
| X |
可形成相对分子质量最小的气体单质 |
| Y |
形成的一种单质是天然存在的最硬的物质 |
| Z |
期单质约占空气总体积的1/5 |
| M |
人体内含量最高的金属元素 |
(1)M元素的名称是 。
(2)Y形成的天然存在的最硬的物质是 ,此物质不属于 (填“有机物”或“无机物”)
(3)由X、Y两种元素组成的最简单的有机物是 (填化学式),该有机物中X元素的质量分数为 。
(4)由Y、Z两种元素组成的能用于人工降雨的固体物质是 。
(5)由Z、M 两种元素按原子个数比1︰1组成的化合物,俗称 ,写出它与水反应的化学方程式 。
【2015年广东省】某化肥说明书的一部分如题图。
(1)此包化肥中含氮的质量为 kg。
(2)该化肥的化学性质为:
与碱性物质混用会因放出 气而损失肥效;
‚ ,
(3)该化肥的物理性质为 。
【2015年湖南省株洲市】请用所学的知识回答下列问题:
(1)pH<5.6的降雨称为酸雨。为什么把标准定为5.6?
(2)华雪同学用锌粒与稀硫酸在如图所示的装置中制取氢气,一段时间后不再有气泡产生。在解释“不再有气泡产生”的原因时,华雪同学认为可能是锌粒与稀硫酸脱离了接触,你认为还可能有什么原因?