【2015年四川省宜宾市】元素X、Y、Z、M是初中常见的四种元素。有关信息如下表:
| 元素 |
有关信息 |
| X |
可形成相对分子质量最小的气体单质 |
| Y |
形成的一种单质是天然存在的最硬的物质 |
| Z |
期单质约占空气总体积的1/5 |
| M |
人体内含量最高的金属元素 |
(1)M元素的名称是 。
(2)Y形成的天然存在的最硬的物质是 ,此物质不属于 (填“有机物”或“无机物”)
(3)由X、Y两种元素组成的最简单的有机物是 (填化学式),该有机物中X元素的质量分数为 。
(4)由Y、Z两种元素组成的能用于人工降雨的固体物质是 。
(5)由Z、M 两种元素按原子个数比1︰1组成的化合物,俗称 ,写出它与水反应的化学方程式 。
氢是实现碳中和的能源载体。
(1)煤制氢的原理可表示为 。
① 中肯定含有的元素是 。
②煤制氢的不足是 (写出一点)。
(2)甲烷制氢包括重整、转化和分离等过程。甲烷制氢过程中产生的 和 的混合气分离得到 的过程如下:

①海水作为吸收剂时,下列措施有利于海水吸收二氧化碳的是 (填序号)。
a.升高海水的温度
b.加快混合气的流速
c.增大气体的压强
②利用 溶液吸收 ,将其转化为 , 在加热条件下即可分解生成 。比较 和 分解反应的不同,可推知 的稳定性 (填“>”或“<”) 的稳定性。
③使用氢氧化钠溶液吸收二氧化碳并分离出氢气。补充完整氢氧化钠循环使用的方案。
步骤1:将氢气和二氧化碳的混合气通入足量的氢氧化钠溶液中。
步骤2:向步骤1所得的溶液中 。
步骤3:过滤,得滤渣和氢氧化钠溶液。
(3)某种利用太阳能制氢的过程如图1所示。

①反应I的基本类型为 。
②写出反应Ⅱ的化学方程式: 。
(4)我国2030~2050年各种能源使用预期情况如图2所示。
①图2所涉及的能源中,属于不可再生能源的是 。

②2030~2050年,预期我国能源结构的变化趋势是 。
是化学实验中常见试剂。
(1)验证质量守恒定律。
步骤1:在锥形瓶中加入适量的 溶液,塞好橡胶塞。将几根铁钉用砂纸打磨干净,将盛有 溶液的锥形瓶和铁钉一起放在托盘天平上称量,记录所称质量为 。
步骤2:将铁钉浸入到 溶液中,塞好橡胶塞。观察实验现象,待反应有明显现象后,将盛有 溶液和铁钉的锥形瓶一起放在托盘天平上称量,记录所称质量为 。
①用砂纸将铁钉打磨干净的作用是 。
②步骤2中可观察到明显的实验现象是 。该变化可说明 和 的金属活动性由强到弱的顺序是 。
③若 ,可证明参加反应的 和 的质量总和等于 。
(2)探究 溶液对 分解具有催化作用。
①若要证明 溶液对 分解具有催化作用,除需证明 在反应前后化学性质和质量不发生改变外,还需证明的是 。
②为探究 在反应前后质量是否发生改变,某同学设计如下实验:
向 溶液中滴入10g a%的 溶液,待反应完全后,向试管中加入足量的 溶液,产生沉淀,过滤、洗涤、干燥,称量沉淀物为 。
上述实验步骤中若缺少“洗涤、干燥”,则通过沉淀物 计算出溶液中 的质量 。(填“大于”或“小于”或“等于”)
(3)将16.0g 置于坩埚中加热,固体质量与成分随温度变化的曲线如图所示。
①650℃时, 开始发生分解反应,生成 和另一种氧化物 , 的化学式为 。
②1000℃时, 开始发生分解反应,生成 和 。计算图中 的值。(写出计算过程,否则不得分)

硫酸是世界上产量最大、用途最广的酸,被称为“化学工业之母”。化学兴趣小组同学对硫酸进行了多角度的研究。
【物质制备】
(1)工业上采用接触法制硫酸:先煅烧黄铁矿得到 ,再将 经过一系列变化得到硫酸。 中硫元素的化合价是 。
【物质性质】
(2)用温度计的水银球一端蘸取浓硫酸,取出后在空气中放置一段时间,观察到温度计示数上升,是因为浓硫酸能吸收 ,并放出热量。
(3)请利用如图提供的仪器与药品,探究稀硫酸与氢氧化钠溶液的反应。

①取 (填“A”或“B”)中的氢氧化钠溶液5mL加入烧杯中,并插入pH计。
②从另一试剂瓶中取出稀硫酸逐滴加入①的溶液中,并用 (填仪器名称)不断搅拌。反应过程中溶液pH变化的部分数据如下表所示:
|
稀硫酸体积/mL |
0 |
2 |
4 |
6 |
8 |
…… |
|
溶液pH |
13.1 |
12.8 |
12.3 |
11.5 |
10.4 |
…… |
③在pH=12.8时,溶液中的溶质是 (填化学式)。
④滴加稀硫酸过程中,溶液pH不断减小的原因有:
a.硫酸与氢氧化钠发生了反应;
b.
⑤为证明溶液pH从13.1减小到10.4的过程中,④中原因a起主要作用,需设计的实验方案是 。
【定量研究】
(4)某工厂现有含碳酸钠的废水需要处理。为测定废水中碳酸钠的质量分数,化学兴趣小组同学取废水样品100g,加入溶质质量分数为10%的硫酸溶液9.8g,恰好完全反应,反应的化学方程式: (此废水中其他物质不与硫酸反应)。计算废水中碳酸钠的质量分数(写出计算过程)。
化学兴趣小组设计了如图所示两个装置,以 溶液为原料制备 ,可灵活控制气体的产生与停止。

(1)甲装置用 作催化剂,先用黏合剂将 粉末制成团状。
①仪器a的名称是 。
②团状 应放在 (填“试管底部”或“多孔隔板上”)。
③打开活塞K,经仪器a向试管中缓慢加入 溶液至浸没团状 ,立即产生 ,收集完后, (填操作),反应随后停止。
(2)乙装置用铂丝(可上下抽动)作催化剂。安全管下端浸没于 溶液中,将铂丝插入溶液,立即产生 。
①若烧瓶内压强过大,安全管中出现的现象是 。
②当出现上述现象时,应采取的措施是 。
(3)取100g 溶液加入乙装置的烧瓶中,完全反应后,测得生成2.56g 。计算 溶液的溶质质量分数(写出计算过程)。
化学兴趣小组利用中和反应测定某 溶液的浓度,实验过程如下:
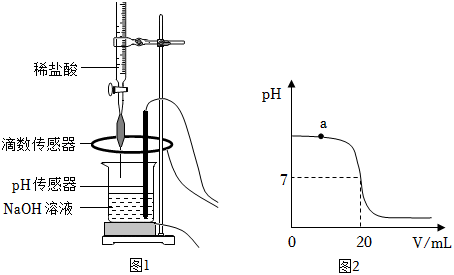
(1)配制稀盐酸:取 的浓盐酸,加水稀释成 的稀盐酸。所得稀盐酸中溶质的质量为_____;
(2)常温下,测定 溶液浓度:
Ⅰ.取 待测 溶液于烧杯中,按图1所示将上述稀盐酸滴入,通过数字化传感器同时测定滴入烧杯内盐酸的体积和烧杯内溶液的 ,得到如图2所示曲线。
Ⅱ.当 溶液与稀盐酸恰好完全反应时,所得溶液的 为_____。经计算,此时已滴入烧杯内的稀盐酸中,所含溶质的质量为 。
设 溶液中溶质的质量为 。
列出比例式__________
求解
答: 溶液中溶质的质量分数为 __________(列式并计算结果);
(3)写出a点对应的溶液中大量存在的分子、离子__________(用化学符号表示)。