化学兴趣班的同学准备分组进行气体的制取与性质的探究实验,实验员准备了如图仪器,同学们根据所学知识完成下列题目。
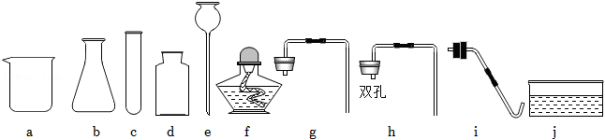
(1)请写出如图中对应字母编号为“e”的仪器名称 。
(2)甲小组的同学准备利用过氧化氢溶液制得较多量的氧气,同时便于添加液体试剂,应选择如图中的 (选填字母编号)来组成发生装置,生成氧气的化学方程式为 。
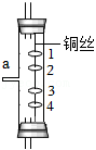
(3)乙小组的同学利用甲小组组装的发生装置制得了二氧化碳气体,并将气体从如图a端通入以探究二氧化碳的性质,其中1、4为湿润的石蕊棉球,2、3为干燥的石蕊棉球。同学们观察到2、3棉球不变色,1、4棉球变红且4棉球先变红,根据实验现象可得出二氧化碳的物理性质是 ,二氧化碳的化学性质是(用化学方程式表示) 。
如图是实验室制取气体的常用装置。请回答下列问题。

(1)写出装置B中仪器①的名称 。
(2)实验室用高锰酸钾制取一瓶较纯净的氧气,应选择的装置是 (填字母),发生反应的化学方程式是 。
(3)实验室制取二氧化碳应选择的收集装置是 (填字母),检验二氧化碳已集满的方法是 。
根据如图所示实验回答问题。

(1)A实验:探究酸与指示剂的作用, (填“a”或“b”)中的液体变红。
(2)B实验:向盛有水的小烧杯中加入少量品红,静置。一段时间后,观察到烧杯中溶液呈均匀的红色。此现象说明分子 。
(3)C实验:Ⅰ中的蜡烛很快熄灭,Ⅱ中的蜡烛正常燃烧。说明可燃物燃烧的条件之一是 。
(4)D实验:量液时,量筒必须放平,视线要与量筒内液体 保持水平,再读出液体的体积。
请结合下列实验室制取气体的常见装置回答相关问题。

(1)仪器a的名称是 。
(2)实验室利用A装置制取氧气的化学方程式是 ;若用E装置收集氧气,验满时应将带火星的木条放在 处。(填①或②)
(3)若用B装置制取 气体,长颈漏斗下端管口必须伸入液面下的原因是 ;若用D装置干燥 气体,D装置中应盛放 。
(4)B、C装置均可用来制取气体,C装置的优点是能控制反应的发生和停止,其原理是 ;实验室更多使用B装置制取气体的原因是 。(答一点即可)
如图为实验室制取气体的常用装置和仪器,请根据所学知识回答下列问题:

(1)编号①仪器的名称是 。
(2)实验室欲制取并收集一瓶较纯净的氧气,已选择A装置,还需要选择的仪器有 ,(填字母序号),该反应的化学方程式为 。利用上述方法收集氧气时,当观察到 时开始收集。
(3)实验室制取二氧化碳的发生装置是 (填“A”或“B”),检验二氧化碳是否集满的方法为 。
如图都是初中化学常见的实验,请根据图示回答问题:

(1)图1实验中高锰酸钾能溶解在水中,却几乎不能溶解在汽油中。由此可知,物质的溶解性与 有关。
(2)图2实验中铜片上白磷燃烧,红磷不燃烧。由此可以得出燃烧的条件之一是 。
(3)图3为测定空气中氧气含量的实验。实验结束后发现测定结果偏小,可能的原因是 (写出一种原因即可)。
(4)图4为稀释浓硫酸的实验。其中a中盛放的物质是 。