2﹣噻吩乙醇( )是抗血栓药物氯吡格雷的重要中间体,其制备方法如图:

Ⅰ.制钠砂。向烧瓶中加入 液体A和 金属钠,加热至钠熔化后,盖紧塞子,振荡至大量微小钠珠出现。
Ⅱ.制噻吩钠。降温至 ,加入 噻吩,反应至钠砂消失。
Ⅲ.制噻吩乙醇钠。降温至 ,加入稍过量的环氧乙烷的四氢呋喃溶液,反应 。
Ⅳ.水解。恢复室温,加入 水,搅拌 ;加盐酸调 至 ,继续反应 ,分液;用水洗涤有机相,二次分液。
Ⅴ.分离。向有机相中加入无水 ,静置,过滤,对滤液进行蒸馏,蒸出四氢呋喃、噻吩和液体A后,得到产品 。
回答下列问题:
(1)步骤Ⅰ中液体A可以选择__________。
| A. |
乙醇 |
| B. |
水 |
| C. |
甲苯 |
| D. |
液氨 |
(2)噻吩沸点低于吡咯( )的原因是__________。
)的原因是__________。
(3)步骤Ⅱ的化学方程式为__________。
(4)步骤Ⅲ中反应放热,为防止温度过高引发副反应,加入环氧乙烷溶液的方法是__________。
(5)步骤Ⅳ中用盐酸调节 的目的是__________。
(6)下列仪器在步骤Ⅴ中无需使用的是__________(填名称);无水 的作用为__________。

(7)产品的产率为__________(用 计算,精确至 )
明矾石的组成和明矾相似,此外还含有Al2O3和少量的Fe2O3等杂质,它是制取钾肥和冶炼铝的重 要原料,其步骤如下:
回答下列问题:
(1) 明矾石加人足量的稀氨水中浸出时发生反应的离子方程式为________________
(2) 沉淀物A中除含有Fe2O3外,还含有 ________、________。
(3) 操作①的名称为________、冷却结晶、过滤。
(4) 用14mol . L-1的浓氨水配制480 mL 2 mol . L‑1稀氨水:
①所用的容量瓶规格是________。
②稀释浓氨水用的烧杯和玻璃棒如何洗涤?________________________
③下列操作对所配制的稀氨水浓度的影响(填“偏大”、“偏小”或“无影响”
a.洗涤后的容量瓶中有少量蒸馏水:________。
b.浓氨水量取后,所用的量筒用蒸馏水洗涤2〜3次,并将洗涤液转人容量瓶中: 。
(5) 确定钾氮复合肥中含有钾元素的方法是。
(6) 为测定钾氮复合肥中氮元素的质量分数,称取mg钾氮复合肥,加人足量的NaOH浓溶液加热,使产生的气体全部逸出,收集到的氨气折箅成标准状况下的体积为V mL。则钾氮复合肥中氮元素的质量分数为________ (用含m、V的代数式表示)。
二氧化氮(NO2)是一种具有高度活性的气态物质,NO2与Na2O2均具有较强的氧化性,某研究性学习小组对二者能否发生反应进行探究。
【实验】
下列关于实验室制备NO2的说法正确的是_______
a.实验室常用铜和浓硝酸反应制取二氧化氮
b.二氧化氮常用向下排空气法收集
c.二氧化氮易溶于水,尾气可用水吸收.
d.用注射器收集的二氧化氮,压缩后颜色变浅
e.实验后容器中残留液需用碱液处理
【提出假设】
假设一:NO2与Na2O2二者不反应;
假设二:NO2能被Na2O2氧化;
假设三:
【查阅文献】
NO2在反应中能生成HNO3和HNO2;HNO2旣有氧化性,又有还原性,能被强氧化剂如KMnO4氧化。
【设计实验】
(1)实验时,将NO2气体通入盛有Na2O2的玻璃管中,淡黄色粉末完全变成白色,说明假设不成立。
(2)若假设二成立,反应的化学方程式是。
(3)为验证假设二是否成立,该小组同学做了如下定性实验研究,请完成下表内容。
| 实验步骤 (不要求写具体操作过程,仪器任选) |
预期的实验现象及结论 |
| 取适量的白色固体置于试管中,………… |
【定量分析】
若实验前该小组同学用托盘天平称量过氧化钠的质量为3.9g,充分反应后白色固体质量为8.4g,该小组同学得出假设2不成立的结论。你是否同意他们的结论,并简述理由:
钛(Ti)被誉为21世纪金属。冶炼钛的主要原料是含Fe2O3的钛铁矿(FeTiO3),其生产过程如下:
已知:TiOSO4可溶于水且易水解,H2TiO3难溶于水。试回答下列问题:
(1)步骤②的主要实验操作是冷却、结晶、(填操作名称);步骤④在实验室中常将试剂置于(填仪器名称)中加强热。
(2)步骤③中加入热水的作用是。
(3)步骤④中硫酸亚铁晶体(FeSO4·7H2O)在空气中煅烧生成铁红、水和三氧化硫,写出该反应的化学方程式:。
(4)步骤②所得到的硫酸亚铁晶体(FeSO4·7H2O)是目前工业上处理含铬有毒废水常用的化学试剂,二者反应后(Cr由+6价转化为+3价)可以转化为有重要工业价值的铁氧体复合氧化物(常用FeO·FeyCrxO3表示)。欲制备该铁氧体复合氧化物,试求在酸性的含铬废水中,加入FeSO4·7H2O的质量应为废水中六价铬(相当于CrO3)质量的倍。
合肥市某校化学兴趣小组为探究铁与浓硫酸反应,设计了如下图所示装置进行实验。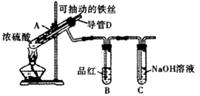
(1)实验过程中,观察到B中的实验现象是。
一段时间后,观察到从C中有少量的气泡冒出,此气泡的成分是。
(2)用“可抽动的铁丝”代替“直接投入铁片”的优点是,反应结束后,不需要打开胶塞,就可使装置中残留气体完全被吸收,应当采取的操作是。
(3)反应一段时间后,他们对A中溶液的金属阳离子进行了探究。
①提出假设:
假设1:溶液中只存在Fe2+;
假设2.;
假设3:溶液中存在Fe2+和Fe3+。
②请你设计实验验证上述假设1,写出实验操作、实验现象及结论。
限选试剂:KMnO4溶液、NaOH溶液、淀粉一KI溶液、KSCN溶液
| 实验操作步骤 |
实验现象 |
结论 |
实验室里用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·7H2O),其过程如下:
(1)过程①中,FeS和O2、H2SO4反应的化学方程式为。
(2)过程②中产生的尾气会对大气造成污染,可选用下列试剂中的吸收。
a.浓H2SO4 b.蒸馏水 c.NaOH溶液 d.浓硝酸
(3)过程③中,需要加入的物质名称是
(4)过程④的实验操作是
(5)过程⑥中,将溶液Z加热到70~80℃,目的是。
(6)实验室为测定所得到的聚铁样品中铁元素的质量分数,进行下列实验。①用分析天平称取样品2.700 g;②将样品溶于足量盐酸后,加人足量的氯化钡溶液;③过滤、洗涤、干燥,称量,得固体质量为3.495 g。若该聚铁主要成分为[Fe(OH)SO4]n,则该聚铁中铁元素的质量分数为。