钛(Ti)被誉为21世纪金属。冶炼钛的主要原料是含Fe2O3的钛铁矿(FeTiO3),其生产过程如下:
已知:TiOSO4可溶于水且易水解,H2TiO3难溶于水。试回答下列问题:
(1)步骤②的主要实验操作是冷却、结晶、 (填操作名称);步骤④在实验室中常将试剂置于 (填仪器名称)中加强热。
(2)步骤③中加入热水的作用是 。
(3)步骤④中硫酸亚铁晶体(FeSO4·7H2O)在空气中煅烧生成铁红、水和三氧化硫,写出该反应的化学方程式: 。
(4)步骤②所得到的硫酸亚铁晶体(FeSO4·7H2O)是目前工业上处理含铬有毒废水常用的化学试剂,二者反应后(Cr由+6价转化为+3价)可以转化为有重要工业价值的铁氧体复合氧化物(常用FeO·FeyCrxO3表示)。欲制备该铁氧体复合氧化物,试求在酸性的含铬废水中,加入FeSO4·7H2O的质量应为废水中六价铬(相当于CrO3)质量的 倍。
绿矾晶体(FeSO4·7H2O,M=278g/mol)是治疗缺铁性贫血药品的重要成分。实验室利用硫酸厂的烧渣(主要成分为Fe2O3及少量FeS、SiO2),制备绿矾的过程如下: 试回答:
试回答:
(1)操作Ⅰ为(填写操作名称)。
(2) 试剂Y与溶液X反应的离子方程式为。
(3)检验所得绿矾晶体中含有Fe2+的实验操作是。
(4)操作Ⅲ的顺序依次为:、冷却结晶、过滤、 、干燥。
(5)某同学用酸性KMnO4溶液测定绿矾产品中Fe2+含量:
a.称取11.5g绿矾产品,溶解,配制成1000mL溶液;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
①步骤a配制溶液时需要的玻璃仪器除玻璃棒、量筒、烧杯、胶头滴管外,还需。
②该同学设计的下列滴定方式,最合理的是(夹持部分略去)(填字母序号)。
③滴定时发生反应的离子方程式为:。
④判断此滴定实验达到终点的方法是;若在滴定终点读取滴定管刻度时,俯视KMnO4溶液液面,其它操作均正确,则使测定结果(填“偏高”“偏低”“无影响”)。
⑤计算上述样品中FeSO4·7H2O的质量分数为。
达州市渠县境内含有丰富的深层地下食盐资源,食盐是日常生活中的必需品,也是重要的化工原料。
(1)经测定该县深层地下粗盐中含有少量K+、Ca2+、Mg2+、Fe3+等杂质离子,某研究性学习小组在实验室提纯NaCl的流程如下:
所提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、75%乙醇溶液、CCl4,仪器及用品自选。
①欲除去溶液中的Ca2+、Mg2+、Fe3+、SO42-,选出a操作中所代表的试剂,按滴加顺序依次为
(只填化学式),b步操作的名称是。
②洗涤除去NaCl晶体表面附带的少量KCl,应选用试剂是,用PH试纸测定滤液ⅡPH值的方法是。
(2)用提纯的NaCl配制500mL,2.5mol·L-1的NaCl溶液,所需仪器除烧杯,托盘天平(砝码和镊子),药匙,玻璃棒外,还需要(填仪器名称),应称取NaClg
(3)下列操作会导致所配NaCl溶液浓度偏高的是
| A.定容完毕后,盖塞,摇匀,再将容量瓶置于实验台上,发现液面低于刻度线,再添加蒸馏水至刻度线。 | |
| B.未将洗涤烧杯内壁的溶液转入容量瓶。 | C.定容时,俯视刻度线。 |
| D.转移溶液之前,容量瓶内有少量蒸馏水。 E、称量时,天平指针指向左盘。 |
某化学学习小组借助下列装置(夹持装置已略)及相关试剂粗略测量空气中O2的体积百分数。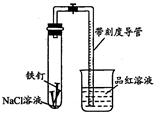
(1)实验前用碱液清洗铁钉,再用0.100mol/L的H2SO4溶液浸泡至有气泡产生。用H2SO4溶液浸泡的目的是_____。
(2)为尽量减小误差,下列操作的正确顺序是______(填序号)。
①装人铁钉②插入注射器向铁钉表面滴入适量 NaCl溶液并打开止水夹③将导管口浸入品红溶液④塞 上单孔活塞⑤检查装置气密性
(3)实验中试管内发生的总反应为______;用该实验方案测量空气中O2的体积百分数时应测量的数据是:①导管与试管内部空间总体积,②______。
(4) 实验时发现上述测量过程因反应较慢耗时较长,对其影响因素作如下分析,请补充 写出假设三:
假设一:电解质溶液的PH不同
假设二:NaCl溶液的浓度不同
假设三:
(5)借助上述实验装置,通过调节溶液的pH验证假设一,获得了如下实验数据:
①当pH=2时,没有观察到稳定液柱形成的原因是______
②根据实验数据分析,为缩短实验测定时间,pH的最佳范围是______
③按上述实验装置,设计实验证明假设二。
第一步:___________;
第二步::相同温度下,加入系统表面积的铁钉,组装两套完全相同的上述装置,分别用注射器将NaCl溶液滴入铁钉表面;
第三步:记录形成稳定液柱所用时间和液柱的高度,比较分析数据得出结论。
阿司匹林的有效成分是乙酰水杨酸( )。实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成乙酰水杨酸,制备的主要反应为:
)。实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成乙酰水杨酸,制备的主要反应为:
操作流程如下:
已知:水杨酸和乙酰水杨酸均微溶于水,但其钠盐易溶于水,醋酸酐遇水分解生成醋酸。
回答下列问题:
(1)合成过程中最合适的加热方法是。
(2)制备过程中,水杨酸会形成聚合物的副产物。写出该聚合物的结构简式。
(3)粗产品提纯:
① 分批用少量饱和NaHCO3溶解粗产品,目的是。判断该过程结束的方法是。
② 滤液缓慢加入浓盐酸中,看到的现象是。
③ 检验最终产品中是否含有水杨酸的化学方法是。
(4)阿司匹林药片中乙酰水杨酸含量的测定步骤(假定只含乙酰水杨酸和辅料,辅料不参与反应):
Ⅰ.称取阿司匹林样品m g;Ⅱ.将样品研碎,溶于V1 mL a mol·L-1NaOH(过量)并加热,除去辅料等不溶物,将所得溶液移入锥形瓶;Ⅲ.向锥形瓶中滴加几滴甲基橙,用浓度为b mol·L-1的标准盐酸到滴定剩余的NaOH,消耗盐酸的体积为V2mL。
① 写出乙酰水杨酸与过量NaOH溶液加热发生反应的化学方程式
。
② 阿司匹林药片中乙酰水杨酸质量分数的表达式为。
氧化亚铜是大型水面舰船防护涂层的重要原料。某小组进行如下研究,请填写下列空白。
实验1:氧化亚铜的制取氧化亚铜可用葡萄糖和新制氢氧化铜悬浊液反应制取。文献表明,条件控制不当时会有少量CuO生成。
(1)实验室制取氢氧化铜悬浊液的离子方程式为____________。
(2)实验室用此方法制取并获得少量氧化亚铜固体,需要的玻璃仪器有试管、酒精灯、烧杯____________和____________。
(3)若要探究该反应发生的最低温度,应选用的加热方式为____________。
实验2:测定氧化亚铜的纯度
方案1:称取实验1所得固体m g,采用如下装置进行实验。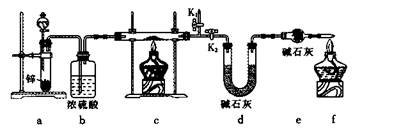
(4)装置a中所加的酸是____________(填化学式)。
(5)通过测出下列物理量,能达到实验目的的是____________。
| A.反应前后装置a的质量 |
| B.装置c充分反应后所得固体的质量 |
| C.反应前后装置d的质量 |
| D.反应前后装置e的质量 |
(6)在氢气验纯后,点燃装置c中酒精灯之前需要对K1、K2进行的操作是____________
方案2:将实验l所得固体mg溶于足量稀硫酸,经过滤、洗涤、干燥后称出不溶物的质量(资料:Cu2O+2H+=Cu2++Cu+H2O)
(7)判断经干燥器干燥后的不溶物是否巳完全干燥的操作方法是__________________________________。
(8)若实验所得不溶物为ng,则该样品中氧化亚铜的质量分数为________________。