聚苯乙烯是一类重要的高分子材料,可通过苯乙烯聚合制得。
Ⅰ.苯乙烯的制备
(1)已知下列反应的热化学方程式:
①
②
③
计算反应④ _____ ;
(2)在某温度、 下,向反应器中充入 气态乙苯发生反应④,其平衡转化率为 ,欲将平衡转化率提高至 ,需要向反应器中充入_____ 水蒸气作为稀释气(计算时忽略副反应);
(3)在 下,以水蒸气作稀释气、 作催化剂,乙苯除脱氢生成苯乙烯外,还会发生如下两个副反应:
⑤
⑥
以上反应体系中,芳香烃产物苯乙烯、苯和甲苯的选择性 ( )随乙苯转化率的变化曲线如图所示,其中曲线 代表的产物是_____,理由是__________;

(4)关于本反应体系中催化剂 的描述错误的是_____;
| A. |
射线衍射技术可测定 晶体结构 |
| B. |
可改变乙苯平衡转化率 |
| C. |
降低了乙苯脱氢反应的活化能 |
| D. |
改变 颗粒大小不影响反应速率 |
Ⅱ.苯乙烯的聚合
苯乙烯聚合有多种方法,其中一种方法的关键步骤是某 (Ⅰ)的配合物促进 (引发剂, 表示卤素)生成自由基 ,实现苯乙烯可控聚合。
(5)引发剂 中活性最高的是_____;
(6)室温下,① 在配体 的水溶液中形成 ,其反应平衡常数为 ;
② 在水中的溶度积常数为 。由此可知, 在配体 的水溶液中溶解反应的平衡常数为_____(所有方程式中计量系数关系均为最简整数比)。
(本小题15分)为测定空气中CO2含量,做下述实验。
| 配0.1mol/L的标准盐酸和0.01mol/L的标准盐酸 |
→ |
用0.1mol/L的标准盐酸滴定未知Ba(OH)2溶液10mL用去盐酸19.60 mL |
→ |
用Ba(OH)2溶液吸收空气中的CO2 |
→ |
过 滤 |
→ |
取滤液20mL,用0.01mol/L的盐酸滴定用去盐酸34.8mL |
(1)为配置标准溶液,请选取必需的一组仪器。
①托盘天平 ②容量瓶 ③滴定管 ④量筒 ⑤烧杯 ⑥胶头滴管 ⑦玻璃棒
| A.①②⑤⑥ | B.②④⑤⑥⑦ | C.②①⑥⑦ | D.②④⑤⑥ |
(2)滴定操作时,左手,眼睛注视。
(3)取上述Ba(OH)2溶液10mL放入100mL容量瓶中,加水稀释至刻度,把稀释后的溶液放入密闭容器,并引入10L空气,振荡,过滤。需过滤的原因是。
(4)由实验数据算出空气中CO2的体积分数为。
(5)本实验中,若第一次滴定时使用的酸式滴定管未经处理,即更换溶液,进行第二次滴定,导致实验数据值(填偏高、偏低或无影响)。
(15分)海水中溴元素以Br-形式存在,工业上用空气吹出法从海水中提取溴的工艺流程如下图: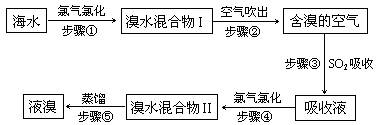
(1)步骤①反应的离子方程式是。
(2)步骤③反应的化学方程式是。
(3)Br的原子序数是,在周期表中位于周期族。
(4)步骤⑤蒸馏的过程中,温度应控制在80~90℃。温度过高或过低都不利于生产,请解释原因:。
(5)为什么不直接用“溴水混合物I”而要用“溴水混合物II”进行蒸馏,得到液溴?
。
已知:以铜作催化剂,用空气氧化醇制取醛,事实上是空气先与铜反应生成氧化铜,热的氧化铜再氧化醇生成醛。某实验室中用甲醇、水、空气和铜粉(或氧化铜)制取甲醛溶液。下表给出甲醇、甲醛的沸点和水溶性:
| 沸点/℃ |
水溶性 |
|
| 甲醇 |
65 |
与水混溶 |
| 甲醛 |
-21 |
与水混溶 |
下图是两个同学设计的实验装置,右边的反应装置相同,而左边的气体发生装置不同,分别如甲和乙所示
请回答下列问题:
(1)在仪器组装完成后,加装试剂前必须要进行的操作是____________________。
(2)若按甲装置进行实验,则通入A的X是______,B中发生反应的化学方程式为__________________________。(有机分子用结构式表示)
(3)若按乙装置进行实验,则B管中应装入的物质是__________。
(4)试管C中应装入的试剂是__________。
(5)两套装置中都需要加热的仪器有______(填A、B、C)。
(6)若欲得到较浓的甲醛溶液,你认为选用哪套装置较好?______(填“甲”或“乙”)。
(7)验证实验后试管C中含有甲醛,所用试剂是__________。
(本小题15分)用二氧化氯(ClO2)、铁酸钠(Na2FeO4摩尔质量为166 g·mol-1)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术。ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+。
(1)如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么,ClO2、Na2FeO4、Cl2三种消毒杀菌剂的消毒效率由大到小的顺序是>>。
(2)铁酸钠之所以能净水,除它本身具有强氧化性外,另一个原因可能是:
。
(3)二氧化氯是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。ClO2可以看做是亚氯酸(HClO2)和氯酸(HClO3)的混合酸酐。工业上用稍潮湿的KClO3和草酸在60℃时反应制得。某学生用如图所示的装置模拟工业制取及收集ClO2,其中A为ClO2的发生装置,B为ClO2的凝集装置,C为尾气吸收装置。请问:
①A部分还应添加温度控制(如水浴加热)装置,B部分还应补充什么装置;
②C中应装的试剂为。C中发生反应的化学方程式为:
。
(本小题15分)根据下列框图关系填空,已知反应①、③是工业生产中的重要反应,D、E常温下为气体、X常温下为无色液体,H与E相对分子质量之间的关系为:Mr(H) -Mr(E) =34,又知C焰色反应火焰呈黄色。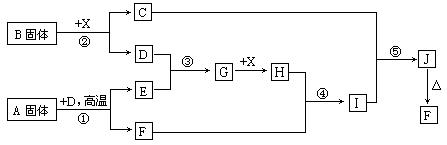
(1) 反应②的化学方程式:__________________________________;
产物C的电子式:_______________________。
(1)化合物A中所包含的化学键有:_______________________。
(2)反应④的离子方程式:_______________________________。
反应⑤的化学方程式:__________________________________。
(3)已知每生成16g E,放出106.5 kJ热量,则反应①的热化学方程式为:
_________________________________________________________ 。