原子序数由小到大排列的四种短周期元素X、Y、 Z、W四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。 M元素与X同主族,与W同周期。
(1)M元素是__________(填元素符号)。
(2)Z、W形成的气态氢物的稳定性为_______>________。(填化学式)
(3)写出M2Z2的电子式_________,写出M2Z2与水反应的离子方程式__________。
(4)由X、Y、Z、W四种元素中的三种组成的—种强酸,该强酸的稀溶液能与铜反应,离子方程式为
__________________________________。
(5)由X、Y、Z、W四种元素组成的一种离子化合物A,已知①1molA能与足量NaOH浓溶液反应生成标准状况下44.8L气体。②A能与盐酸反应产生气体B,该气体能与氯水反应。则A是__________
(填化学式).写出该气体B与氯水反应的离子方程式__________________________________________。(6)由X、Y、 Z、W和Fe五种元素组成的相对分子质量为392的化合物C,1mol C中含有6mol结晶水。对化合物C进行下实验:
a.取C的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体。过一段时间白色沉淀变为灰绿色,最终变为红褐色;
b.另取C的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解
①写出C的化学式为_______________________________________。
②试写出C与M2Z2按物质的量比1:2在溶液中反应的化学方程式____________________________。
请回答下面问题
(1)Mg是第三周期元素,该周期部分元素氟化物的熔点见下表:
| 氟化物 |
NaF |
MgF2 |
SiF4 |
| 熔点/K |
1266 |
1534 |
183 |
解释表中氟化物熔点差异的原因:
。
(2)CO的结构可表示为C≡O,N2的结构可表示为N≡N。下表是两者的键能数据:(单位:kJ·mol-1)
| C-O |
C=O |
C≡O |
|
| CO |
357.7 |
798.9 |
1071.9 |
| N-N |
N=N |
N≡N |
|
| N2 |
154.8 |
418.4 |
941.7 |
CO与N2的结构相似,分子中都含有共价三键,其中含有个π键;结合数据说明CO比N2活泼的原因:
。
第一电离能I1是指气态原子X(g)失去一个电子成为气态阳离子X+(g)所需的能量。下图是部分元素原子的第一电离能I1随原子序数变化的曲线图。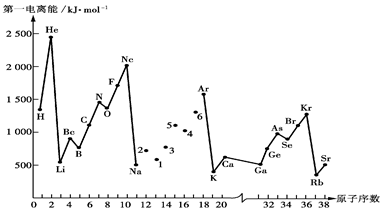
请回答以下问题:
(1)认真分析上图中同周期元素第一电离能的变化规律,将Na——Ar之间六种元素用短线连接起来,构成完整的图像。
(2)从上图分析可知,同一主族元素原子的第一电离能I1变化规律是
。
(3)上图中6号元素在周期表中的位置是 ;其原子M层电子的轨道表示式为。
(4)上图中4,5,6三种元素的气态氢化物的沸点均比同主族上一周期的元素气态氢化物低很多,原因是:。
现有下列几种常见的物质:①N2 ②NaCl ③Ca(OH)2 ④金刚石⑤SiC ⑥NH3
⑦NH4Cl ⑧CO2。其中,(以下空格均填写序号)
(1)含有非极性键的分子晶体是;
(2)含有极性键的分子晶体是;
(3)只含离子键的离子晶体是;
(4)含有极性共价键的原子晶体是;
(5)既含有离子键,又含有极性共价键和配位键的离子晶体是 。
某链烃A的分子式为C6H12,已知其分子中所有的碳原子共平面,且该分子的一氯取代物只有一种,回答下列问题:
(1)A的结构简式为:下列物质与A以任意比例混合,若总物质的量一定,充分燃烧消耗氧气的量相同的是(填序号)。
a.C7H12O2 b.C6H14 c.C6H14O d.C7H14O3
(2)A与Br2的CCl4溶液反应生成B, B与NaOH的醇溶液共热可得到D,D分子中无溴原子。请写出由B制备D的化学反应方程式:。
(3)B与足量NaOH水溶液完全反应,生成有机物E。
①E可能发生的反应类型有(填序号)。
a.取代反应 b.消去反应 c.加聚反应 d.还原反应
②E与乙二醇的关系是(填序号)。
a.同分异构体 b.同系物 c.同一物质 d.同素异形体
(4)E与乙二酸在一定条件下生成分子式为C8H12O4的有机物,请写出该反应的化学反应方程式。
在某有机物A的结构简式如右图。请回答
(1)A跟NaOH溶液反应的化学方程式是:。
(2)A跟NaHCO3溶液反应的化学方程式是:。
(3)A在一定条件下跟Na反应的化学方程式是:。