为探究碳还原氧化铜的最佳实验条件,用木炭粉和氧化铜的干燥混合物1~2.5g进行系列实验。
[查阅资料]①氧化铜(CuO)为黑色固体。
②碳还原氧化铜得到的铜中可能含有少量的氧化亚铜;氧化亚铜为红色固体,能与稀硫酸反应:Cu2O+H2SO4═CuSO4+H2O+Cu。
[进行实验]
实验1:取质量比1:11的木炭粉和氧化铜混合物1.3g,进行实验。
序号 |
1﹣1 |
1﹣2 |
装置 |
|
|
反应后物质的颜色、状态 |
黑色粉末中混有少量红色固体 |
红色固体有金属光泽,混有极少量黑色物质 |
实验2:取一定量的混合物,用1﹣2装置进行实验。
序号 |
木炭粉与氧化铜的质量比 |
反应后物质的颜色、状态 |
|
2﹣1 |
1:9 |
红色固体有金属光泽 |
混有少量黑色物质 |
2﹣2 |
1:10 |
混有很少量黑色物质 |
|
2﹣3 |
1:11 |
混有极少量黑色物质 |
|
2﹣4 |
1:12 |
无黑色物质 |
|
2﹣5 |
1:13 |
混有较多黑色物质 |
|
【解释与结论】
(1)配平化学方程式: C+ CuO Cu+ CO2↑。
(2)实验1﹣2中,证明产生了CO2的现象是 。
(3)实验1的目的是 。
(4)实验2的结论是 。
[反思与评价]
(5)实验2没有进行质量比为1:14的实验,理由是 。
(6)为检验2﹣4的红色固体中是否含Cu2O,所需试剂是 。
24g某氯化钡样品中含有少量的氯化钠,某同学进行了如图所示的实验。请计算:

(1)生成沉淀的质量;
(2)D烧杯中所得溶液的溶质质量分数。
高铁酸钠(化学式Na2FeO4)是一种新型高效的水处理剂。请回答下列问题:
(1)高铁酸钠中钠元素和氧元素的原子个数比 ;
(2)高铁酸钠中铁元素和氧元素的质量比 ;
(3)高铁酸钠中 元素的质量分数最大;
(4) g高铁酸钠中含有铁元素的质量是2.8g。
对比实验是化学研究中经常采用的方法。化学兴趣小组的同学在研究CO2通入NaOH溶液是否发生了反应,设计了下列两组实验,请和化学兴趣小组的同学一起探究并回答问题。
[设计与实验]
|
实验 序号 |
实验 步骤一 |
实验 步骤二 |
实验 序号 |
实验 步骤一 |
实验 步骤二 |
|
实 验 Ⅰ |
|
|
实 验 Ⅱ |
|
|
[探究与结论]
(1)实验Ⅰ中步骤一看不到明显现象,步骤二产生的现象是 ;
(2)实验Ⅱ中步骤二看到有白色沉淀析出,则发生反应的化学方程式 ;
(3)在实验Ⅱ的步骤一中CO2与NaOH溶液一定发生了化学反应,但却看不到明显的现象,原因是 。
[拓展延伸]现有资料卡片中的信息:

请你和化学兴趣小组的同学一起利用以上信息再设计实验Ⅲ,证明CO2确实与NaOH发生了化学反应。实验Ⅲ的操作为 ;看到的现象是 。
[交流反思]根据该资料卡片所提供的信息,你能总结出的规律是 。
工业上用闪锌矿(主要含ZnS,还有PbS等杂质)制备Zn,并将产生的废气转换成工业原料,设计流程如图(部分产物略去)。
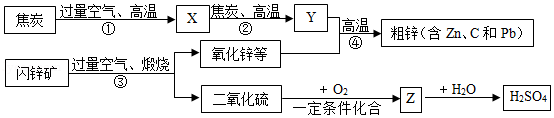
(1)X的化学式 ,图中用过量空气的目的是 ;
(2)①~ ④中属于化合反应的是 ;
(3)Zn (填“能”或“不能”)与氯化铅(PbCl2)溶液反应;
(4)写出③中生成ZnO的化学方程式 ,产生的工业废气SO2在一定条件下与氧气化合生成的Z物质是 (填化学式)。
实验是进行科学探究的主要方法。如图A~H是初中化学常见的实验装置,请回答:
【查阅资料】常温下,CO2难溶于饱和NaHCO3溶液。
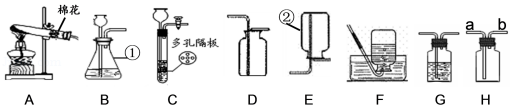
(1)写出仪器名称:① ② ;
(2)写出用装置A制取氧气的化学方程式 ;用双氧水和二氧化锰制取氧气时,选择的发生装置和收集装置的组合是 (写出一种组合即可,填序号);实验室制取氧气时,选择的药品在组成上的共同点是 ;将制得的氧气通入图中,发现只有白磷燃烧,说明燃烧需要满足的条件是 。
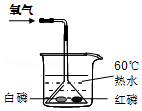
(3)实验室用大理石和稀盐酸制取二氧化碳,既可以选用装置B又可选用装置C,相对于装置B,装置C的突出优点是 ;若用装置H收集二氧化碳时,气体应该从 (选填“a”或“b”)端通入;若用装置G除去生成气体中混有的氯化氢气体,则装置G中应盛放 。