学习金属活动性顺序后,老师安排同学们开展系列实验探究金属间的置换反应规律。小明做完铝条和氯化铜溶液反应的实验后,将反应后的无色溶液(以下简称:待测溶液)倒入有水的废液缸中时,发现有白色沉淀析出的“异常现象”。小明设计实验开展了如下探究。请根据要求回答有关问题:
【发现问题】
小明取一滴管未倒完的待测溶液,将其注入盛有约三分之二试管体积的水中,依然产生大量白色沉淀(像牛奶一样)。
【提出问题】
待测溶液注入水中为什么有白色沉淀产生?白色沉淀是什么物质?
【查阅资料】
(1)AlCl3是一种无色透明晶体,极易与水反应生成难溶于水的Al(OH)3而产生白色沉淀;
(2)CuCl是一种不溶于水的白色固体,易溶于一定浓度的KCl、NaCl等含Cl﹣的溶液中;CuCl中Cu的化合价为 。
【提出猜想】
猜想Ⅰ:白色沉淀是Al(OH)3
猜想Ⅱ:白色沉淀是CuCl
猜想Ⅲ:白色沉淀是Al(OH)3和CuCl的混合物
【实验探究】
序号 |
实验操作 |
实验现象 |
实验结论 |
① |
取一滴管待测溶液,将其注入盛有约三分之二试管体积一定浓度的NaCl溶液中 |
无明显实验现象 |
猜想 正确 |
② |
取约2mL待测溶液于试管中,向溶液中插入足量洁净的Al条,充分反应 |
有红色固体析出 |
|
③ |
取一滴管实验②后的溶液,将其注入盛有约三分之二试管体积的水中 |
无明显实验现象 |
【结论与反思】
(1)上述实验表明,Al和CuCl2溶液的反应是分步进行的。第一步反应生成CuCl,第二步CuCl继续和Al反应生成Cu。请分别写出上述两步反应的化学方程式:第一步: ,第二步: 。
(2)待测溶液中含有大量CuCl,为什么它没有以白色沉淀的形式存在?请说明原因: 。
(3)设计实验③的目的是 。
【启示与拓展】
通过对Al和CuCl2溶液反应的实验探究,使我们认识到,我们不少的传统认识远没有做到细致入微,特别是当观察到有红色固体析出,于是就贸然断定这个反应是个简单的、一步完成的置换反应。实际上还要关注物质变化的过程,通过比较和分析,得出可靠的结论。经过无数次实验证明,有些化学反应看似一步完成,实际上是分步进行的。请根据你所学知识,任举一例反应可能分步进行的实例: 。
双休日后,小丽带着快乐的心情返回学校。当她来到实验室时,意外地发现实验桌上有瓶敞口放置已久的NaOH溶液,由此,激发了她的探究欲望。
《提出问题》这瓶NaOH溶液一定变质了,其变质程度如何呢?
《提出猜想》小丽的猜想:NaOH溶液部分变质
你的新猜想: 。
《实验探究》小丽设计如下实验来验证自己的猜想,请根据表中内容填写小丽实验时的现象:
假设你的猜想正确,并按小丽的实验方案进行实验,则你观察到的实验现象是
。
《实验反思》下列物质①BaCl2溶液、②Ca(NO3)2溶液、③Ca(OH) 2溶液、④Ba(OH)2
溶液,能替代小丽实验中CaCl2溶液的是 (填序号)。
《拓展应用》小丽想测定这瓶变质的NaOH溶液中Na2CO3的质量分数。现取20g待测溶液,向其中逐滴加入CaCl2溶液,产生沉淀质量与所加CaCl2物质的量的关系如图所示。
(1)B点处所得溶液中溶质有 。
(2)求待测溶液中Na2CO3的质量分数。
(写出计算过程)
小明同学利用已有的知识弄清家里化肥的成分,他看到袋中化肥是白色晶体,用少量肥料跟熟石灰一起研磨,有浓烈的刺激性气味,初步判定是一种氮肥。
为进一步证实肥料的成分,小明将少量肥料样品带到学校进行探究。
| 探究内容 |
现象 |
结论 |
| 实验1:取一定量的肥料放入水中,震荡 |
样品完全溶解 |
_________________ |
| 实验2:取实验1中的部分溶液,滴加石蕊试剂 |
溶液呈红色 |
__________________ |
| 实验3:另取实验1中的部分溶液,滴加氯化钡试剂和稀盐酸 |
有白色沉淀生成 |
该化肥为_________ |
①小明家的化肥是一种铵盐,有同学认为盐的水溶液都呈中性,你同意他的观点吗?请举例说明。____________________________________________________。
②结合探究过程回答,施用该化肥时应注意________________________________。
草酸的化学式为H2C2O4,甲、乙两同学对草酸受热分解及其产物的检验做了探究:
【猜想与假设】
第一种:草酸分解产物是CO2和H2;第二种:草酸分解产物是CO2、CO和H2O ;
第三种:草酸分解产物是 CO2和H2O ;第四种:草酸分解产物是CO2、CO 。
以上猜想,第种一定不可能,原因是。
【查阅资料】无水硫酸铜遇水由白色变成蓝色,碱石灰是一种常用的干燥剂。
【实验设计】(图中铁架台略去)甲同学设计了甲装置,乙同学设计了乙装置。
【实验过程】甲同学按甲装置实验,在给草酸晶体加热时,先,然后固定在底部加热,过一会儿观察到澄清石灰水变浑浊;乙同学按乙装置实验,观察到无水硫酸铜由白色变成蓝色,澄清的石灰水变浑浊,且生成的气体通过碱石灰后,在干燥管的尖嘴处点火能燃烧,乙同学进一步通过实验验证燃烧的气体为CO,他的操作是
,现象是。
【实验结论】第种猜想是正确的。
【反思与评价】乙同学认为甲同学设计的实验装置有缺陷。由于试管口向下倾斜,而且草酸晶体熔点较低,加热到182℃便开始熔化,因此实验中常会出现熔融的草酸流进导管而影响后续实验。甲同学认为乙同学的设计是科学合理的。请你谈谈乙装置优于甲装置之处。(答出一点即可)
化学小组的同学对碳燃烧产生兴趣。
提出问题:将3克碳与8克氧气放入密闭容器中燃烧,产物只有二氧化碳吗?
猜想与假设:燃烧后气体一定含有CO2,可能含有。
查阅资料:向氯化钯(PdCl2) 溶液中通入CO,发生下列反应。请完成化学方程式的书写PdCl2+CO+H2O==Pd↓黑色+CO2+2。
设计实验:小刚设计了下图所示装置。 结合图示回答问题: 实验步骤:
实验步骤:
(1)打开弹簧夹a,关闭弹簧夹b、c 。点燃酒精灯,加热碳粉,A装置中观察到的现象是。
(2)过一会儿,打开弹簧夹b,推动注射器的活塞。
(3)打开弹簧夹c,用注射器向装置中缓缓注入氮气,观察到B中澄清石灰水变浑浊,反应的化学方程式为。小组同学通过实验确定有一氧化碳生成,他们依据的现象是。
实验结论:综合上述实验,并进行理论推导,得出结论。3g碳在8g氧气中燃烧后的混合物中含有。
实验反思:在整个实验过程中,注射器的作用有。
近几年我国某些城市酸雨污染较为严重,主要是因为大量燃烧含硫量高的煤而形成的。
【提出问题】如何通过实验证明煤中含有碳元素和硫元素。
【查阅资料】
(1)“二氧化硫能使高锰酸钾溶液褪色(由紫红色变为无色),该反应的化学方程式为:5SO2 + 2KMnO4 + 2H2O = K2SO4 + 2MnSO4 + 2 H2SO4”。
(2)“二氧化硫和二氧化碳一样,能和澄清石灰石发生反应生成难溶于水的亚硫酸钙(CaSO3),也能使澄清石灰水变浑浊。”请写出二氧化硫使澄清石灰水变浑浊的化学方程式:______________________。
根据上述资料,甲同学、乙同学和丙同学分别设计实验方案进行探究。
【实验探究】
(3)甲同学:
“实验操作”:甲同学进行了如下图所示A、B两步实验: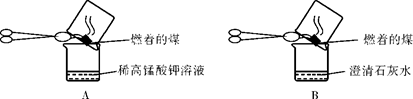
“实验现象”: A,B。
“得出结论”:煤燃烧生成二氧化硫和二氧化碳,证明煤中含有碳元素和硫元素。
(4)乙同学认为甲同学的实验方案不合理,其理由是:。
(5)丙同学:进行了如下图所示实验(部分装置在图中略去):
【探究与结论】(6)上图C装置的作用是。
(7)丙同学的实验中若已证明煤中含有碳元素和硫元素的现象是:丙同学应看到的实验现象是。