常温时,某溶液中由水电离出的H+和OH-的物质的量浓度乘积为1×10-26,该溶液中一定能大量存在的离子组是( )
| A.K+、Ba2+、Cl-、NO3- | B.Fe3+、Cu2+、Cl-、HCO3- |
| C.K+、Na+、SO32-、SO42- | D.Ca2+、Al3+、H+、NO3- |
物质的量之比为2∶3的N2和H2,在一定条件下反应,并达到平衡。在此过程中,下列说法正确的是()
| A.在建立平衡的过程中,N2和H2的物质的量之比始终是2∶3 |
| B.N2的转化率始终为H2转化率的2倍 |
| C.N2的转化率始终为H2转化率的1/2 |
| D.达到平衡时,平衡体系的总物质的量与起始时的总物质的量之比可为1∶2 |
在2 L的密闭容器中进行反应3H2+N2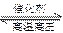 2NH3,经过一段时间后,NH3的物质的量增加0.8 mol,在这段时间内用N2表示的反应速率为0.01 mol·L-1·s-1。则这段时间为()
2NH3,经过一段时间后,NH3的物质的量增加0.8 mol,在这段时间内用N2表示的反应速率为0.01 mol·L-1·s-1。则这段时间为()
| A.10 s | B.20 s |
| C.30 s | D.40 s |
固体氧化物燃料电池是由美国西屋(Westinghouse)公司研制开发的。它以固体氧化锆氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过。该电池的工作原理如下图所示,其中多孔电极a、b均不参与电极反应。下列判断正确的是()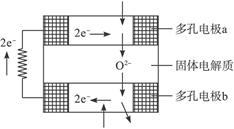
| A.有O2放电的a极为电池的负极 |
| B.有H2放电的b极为电池的正极 |
| C.a极对应的电极反应为O2+2H2O+4e-====4OH- |
D.该电池的总反应方程式为2H2+O2 2H2O 2H2O |
用惰性电极电解M(NO3)x的水溶液,当阴极上增重a g时,在阳极上同时产生b L O2(标准状况),从而可知M的相对原子质量为()
A. |
B. |
C.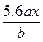 |
D. |
用石墨作电极电解100 mL H2SO4与CuSO4的混保液,通电一段时间后,两极均收集到2.24 L气体(标准状况),则原混合液中Cu2+的物质的量浓度为()
| A.1 mol·L-1 | B.2 mol·L-1 | C.3 mol·L-1 | D.4 mol·L-1 |