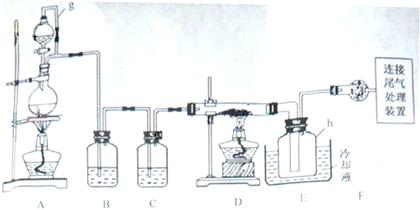
单晶硅是信息产业中重要的基础材料。通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硫、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450-500°C),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。

 相关信息如下:
相关信息如下:
 a.四氯化硅遇水极易水解;
a.四氯化硅遇水极易水解;
 b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
 c.有关物质的物理常数见下表:
c.有关物质的物理常数见下表:


 请回答下列问题:
请回答下列问题:
 (1)写出装置A中发生反应的离子方程式 。
(1)写出装置A中发生反应的离子方程式 。
 (2)装置A中g管的作用是 ;装置C中的试剂是 ;装置E中的h瓶需要冷却理由是 。
(2)装置A中g管的作用是 ;装置C中的试剂是 ;装置E中的h瓶需要冷却理由是 。
 (3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是 (填写元素符号)。
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是 (填写元素符号)。
 (4)为了分析残留物中铁元素的含量,先将残留物预处理,是铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:
(4)为了分析残留物中铁元素的含量,先将残留物预处理,是铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:

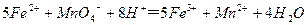
 ①滴定前是否要滴加指示剂? (填“是”或“否”),请说明理由 。
①滴定前是否要滴加指示剂? (填“是”或“否”),请说明理由 。
 ②某同学称取5.000g残留物,预处理后在容量瓶中配制成100ml溶液,移取25.00ml,试样溶液,用1.000×10-2mol· L-1KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00ml,则残留物中铁元素的质量分数是 。
②某同学称取5.000g残留物,预处理后在容量瓶中配制成100ml溶液,移取25.00ml,试样溶液,用1.000×10-2mol· L-1KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00ml,则残留物中铁元素的质量分数是 。
有关下图的说法正确的是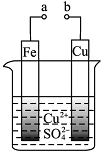
| A.构成原电池时溶液中SO42-移向Cu极 |
| B.构成原电池时Cu极反应为: Cu﹣2e-===Cu2+ |
| C.构成电解池时Fe极质量既可增也可减 |
| D.a和b分别接直流电源正、负极,Fe极会产生气体 |
为了配制NH4+的浓度与Cl―的浓度比为1:1的溶液,可在NH4Cl溶液中加入
①适量NH4NO3 ;②适量NaCl;③适量氨水;④适量NaOH
| A.①② | B.①③ | C.②③ | D.②④ |
下列实验操作或所记录的数据合理的是
| A.NaOH溶液可保存在玻璃塞的试剂瓶中 |
| B.一学生用pH试纸测得某氯水的pH为2 |
| C.液溴应盛放在用水密封且用玻璃塞塞紧的棕色试剂瓶中 |
| D.配制硫酸亚铁溶液,是将绿矾晶体溶于蒸馏水再加入一定量的铁粉 |
对于常温下pH=12的氨水,下列说法正确的是
| A.由水电离产生的c(OH-)=10-12mol·L-1 |
| B.向溶液中加入等体积的pH=2盐酸后溶液呈酸性 |
| C.向溶液中加入稀盐酸可以促进氨水的电离,溶液的碱性增强 |
| D.向溶液中加入适量盐酸使混合液的pH=7,混合液中c(NH4+)>c(Cl-) |
下列与处理方法对应的反应方程式正确的是
| A.用热的Na2CO3溶液去除油污:CO32- + H2O ===HCO3- + OH- |
| B.用FeS去除废水中的Hg2+:Hg2+ + S2-===HgS↓ |
C.用催化法处理汽车尾气中的CO和NO:CO + NO C + NO2 C + NO2 |
D.向污水中投放明矾,生成能凝聚悬浮物的胶体:Al3+ + 3H2O Al(OH)3(胶体)+ 3H+ Al(OH)3(胶体)+ 3H+ |