为了验证“铁丝可以在纯净的氧气中燃烧”及“燃烧产物有中Fe2+、Fe3+的存在”。同学们将一根火柴棒塞入一段螺旋状普通细铁丝末端固定;用镊子将铁丝夹住,然后将火柴在酒精灯上点燃,将铁丝由集气瓶口向下慢慢深入,观察现象:
(1)甲同学只发现铁丝红热一下,然后没有现象了。请你分析铁丝没有燃烧的可能原因 (填序号):
| A.氧气不纯(或没收集满) |
| B.火柴太长消耗了氧气 |
| C.铁丝表面有氧化物(或铁锈) |
| D.没有预热末端铁丝,温度没有达到铁丝的着火点 |
(2)乙同学做了一些准备工作,当铁丝在纯净氧气中燃烧时,火星四射,并有黑色固体生成。现有实验用品:细纯铁铁丝、细含碳铁丝、镁条、细铜丝、集气瓶装的几瓶纯氧、火柴、酒精灯、镊子、砂纸等。请回答:
①你对“没有火焰”的现象,能提出的问题是: ;验证方法是: 。
②为了找出铁丝在纯氧中燃烧“火星四射”的原因,其假设和对应验证方法是:
。
③如果探究发现只有含碳细铁丝在纯氧中燃烧才出现“火星四射”现象,你分析其原因是: 。
(3)丙某同学为了验证“铁在氧气的燃烧产物中有Fe2+、Fe3+的存在”,设计并进行了如下实验:
试回答下列问题:
①试剂1是 ,试剂2是 。
②加入新制氯水后溶液中颜色加深是因为(用离子方程式表示)
。
③该同学猜想血红色溶液一段时间后变为无色溶液的原因是溶液中的+3价铁被还原为+2价铁,你认为该同学的猜想合理吗? 。若你认为不合理,请提出你的猜想 ,并设计一个简单的实验加以验证(若你认为合理,该空不要作答) 。
某校化学小组的同学开展了一系列的化学实验活动。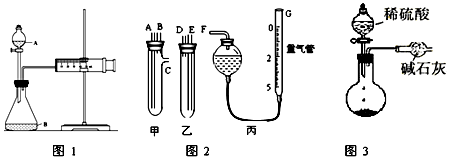
(1)甲同学用图1所示装置,测量锌与硫酸反应速率:把2g锌粒放入锥形瓶内,通过分液漏斗加入1mol·L-1稀硫酸40mL,收集10mL气体,通过记录得到反应速率为XmolL-1·min-1。实验开始时检查该装置气密性的方法是。
(2)乙同学用图2装置测定Na2CO3和NaCl的固体混合物中Na2CO3的质量分数:
①甲、乙两试管各有两根导管,用橡胶管连接对应接口后,倒置盛稀硫酸的试管,发生反应,放出气体,则Na2CO3、NaCl的固体混合物和稀硫酸应分别置于、仪器中(填仪器编号);
②G管可以用化学实验室里的一种常用仪器来替代,这种仪器的名称是;
③仪器甲、乙接口的连接方式如下:A连接,B连接,C连接
(填写各接口的编号)。
④为提高测量的准确性,收集完气体后,丙装置读数前应进行的操作是____________。如果开始读数时操作正确,最后读数时俯视右边滴定管液面,会导致所测气体的体积__________(填“偏大”、“偏小”或“无影响”)。
(3)丙同学与甲同学实验目的相同:用图3装置测定生成的CO2的质量,但该装置存在明显缺陷,从而导致实验误差,请你分析其中使测定结果可能偏大的主要原因。
(每空2分,共18分)
(一)实验室用下图装置制取少量溴苯,试填写下列空白。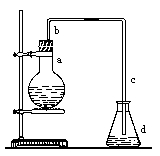
(1)在烧瓶a中装的试剂是。
(2)长直导管b的作用:。
(3)请你分析导管c的下口可否浸没于液面中?(填“可”或 “否”)
(4)反应完毕后,向锥形瓶d中滴加AgNO3溶液,有关反应的离子方程式:。
(二)某课外活动小组利用下图装置进行乙醇的催化氧化实验并制取乙醛,图中铁架台等装置已略去,粗黑线表示乳胶管。请填写下列空白: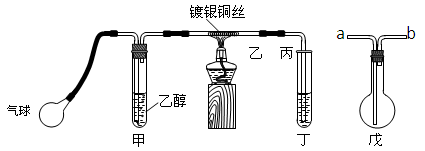
(1)甲装置常常浸在70~80℃的水浴中,目的是
(2)实验时,先加热玻璃管乙中的镀银铜丝,约1分钟后鼓入空气,此时铜丝即呈红热状态。若把酒精灯撤走,控制一定的鼓气速度,铜丝能长时间保持红热直到实验结束。
乙醇的催化氧化反应是________反应(填“放热”或“吸热”),
该反应的化学方程式为。
(3)若试管丁中用水吸收产物,则要在导管乙、丙之间接上戊装置,其连接方法是
(填戊装置中导管代号):乙接、_______接丙;
若产物不用水吸收而是直接冷却,应将试管丁浸在 _____中。
(共10分)化学上常用燃烧法确定有机物的组成.这种方法是在电炉加热时用纯氧气氧化管内样品,根据产物的质量确定有机物的组成.下图所列装置是用燃烧法确定有机物分子式常用的装置.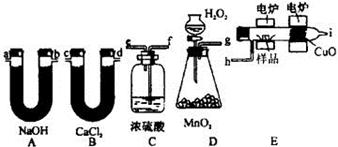
回答下列问题:
(1)产生的氧气按从左到右流向,所选装置各导管的连接序号(填写接口代号)是:
________________________________________;
(2)C装置中浓H2SO4的作用是________________________________;
(3)D装置中MnO2的作用是__________________________________;
(4)燃烧管中CuO的作用是___________________________________;
(5)若准确称取 0.90 g样品(只含 C、H、O三种元素中的两种或三种),经充分燃烧后,
A管质量增加1.32 g,B管质量增加0.54 g,则该有机物所含元素的最简比为___________。
(共11分) 课题式研究性学习是培养学生创造思维的良好方法,某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y 都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试回答下列问题:
(1)电源A 极的名称是___________
(2)乙装置中电解反应的总化学方程式是________________
(3)如果收集甲、乙装置中C、D、E、F产生的物质的物质的量之比是________
(4)欲用丙装置给铜镀银,G应该是_____(填名称),电镀液的主要成分是______(填化学式)
(5)装置丁中Y极附近红褐色变深,说明氢氧化铁胶粒带_________电荷。
(6)从Cu2+、Na+、SO42-、Cl-四种离子中恰当地组成电解质,按下列要求进行电解,
写出所有符合要求的物质化学式。
①、以石墨为电极进行电解,使电解质质量减少,水质量不变,采用的电解质是________
②、以石墨为电极进行电解,使电解质质量不变,水质量减少,采用的电解质是________
③、以碳棒为阳极,铁棒为阴极进行电解,使电解质和水的质量都减少,采用的电解质是___
乙醇的沸点是78℃,能与水以任意比例混溶。乙醚的沸点为34.6℃,难溶于水,在饱和Na2CO3溶液中几乎不溶,乙醚极易燃烧。实验室制乙醚的反应原理是 

(1)图甲和乙是两套实验室制乙醚的装置,选装置最合适,理由是__。
(2)反应液中应加入沸石,其作用是。
(3)反应中温度计水银球的位置是 __________________。
(4)用装置乙制得的乙醚中可能含有大量的杂质,这杂质是,除去这种杂质的简易方法是。
(5)如果温度太高将会有乙烯生成,该反应的化学方程式是
,反应类型是。