某校化学小组的同学开展了一系列的化学实验活动。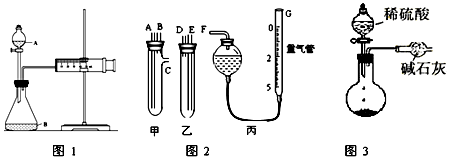
(1)甲同学用图1所示装置,测量锌与硫酸反应速率:把2g锌粒放入锥形瓶内,通过分液漏斗加入1mol·L-1稀硫酸40mL,收集10mL气体,通过记录 得到反应速率为XmolL-1·min-1。实验开始时检查该装置气密性的方法是 。
(2)乙同学用图2装置测定Na2CO3和NaCl的固体混合物中Na2CO3的质量分数:
①甲、乙两试管各有两根导管,用橡胶管连接对应接口后,倒置盛稀硫酸的试管,发生反应,放出气体,则Na2CO3、NaCl的固体混合物和稀硫酸应分别置于 、 仪器中(填仪器编号);
②G管可以用化学实验室里的一种常用仪器来替代,这种仪器的名称是 ;
③仪器甲、乙接口的连接方式如下:A连接 ,B连接 ,C连接
(填写各接口的编号)。
④为提高测量的准确性,收集完气体后,丙装置读数前应进行的操作是____________。如果开始读数时操作正确,最后读数时俯视右边滴定管液面,会导致所测气体的体积__________(填“偏大”、“偏小”或“无影响”)。
(3)丙同学与甲同学实验目的相同:用图3装置测定生成的CO2的质量,但该装置存在明显缺陷,从而导致实验误差,请你分析其中使测定结果可能偏大的主要原因 。
某科研小组用MnO2和浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理。
(1)请写出SO2与过量NaOH溶液反应的离子方程式:__________________________。
(2)吸收尾气(Cl2)一段时间后,吸收液(强碱性)中肯定存在的阴离子有OH—和、。
请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气的CO2的影响)
① 提出合理假设。
假设1:只存在SO32—;
假设2:既不存在SO32—也不存在ClO—;
假设3:_____________。
② 要证明假设1是否成立,设计实验方案,进行实验。请在答题卡上写出实验以及预期现象和结论。限选实验试剂:3mol·L-1H2SO4、1mol·L-1NaOH、0.01mol·L-1KMnO4、淀粉-KI溶液。
| 实验 |
预期现象和结论 |
小苏打(NaHCO3)试样中含有碳酸钠晶体(Na2CO3·10H2O),为测定试样中小苏打的质量分数w(NaHCO3),实验小组同学设计了如下装置进行实验。
实验过程:
Ⅰ、按图组装仪器,检查装置的气密性;
Ⅱ、将试样m1g放入硬质玻璃管中,装置B、C、D中药品如图,已知加药品后装置B的质量为m2 g、装置C的质量为m3 g;
Ⅲ、关闭活塞a,点燃酒精灯加热试样,直到B装置中无气泡冒出后,打开活塞a向装置中通入N2,一段时间后,撤掉酒精灯,关闭活塞a;
Ⅳ、称得装置B的质量为m4 g、装置C的质量为m5 g。
请回答以下问题(装置中原有空气对实验的影响忽略不计):
(1)装置A中发生反应的化学方程式为,。
(2)装置C的作用为。装置D的作用为。
(3)实验过程中通入N2的目的为。
(4)用下列各项所提供的数据能计算出w(NaHCO3)的是(填选项字母)
| 序号 |
a |
b |
c |
d |
e |
| 数据 |
 、 、 、 、 |
 、 、 、 、 、 、 |
 、 、 、 、 |
 、 、 、 、 |
 、 、 、 、 |
(5)实验结束后发现装置A中硬质玻璃管右端有水珠,你认为利用实验中所提供的数据还能否得到准确的w(NaHCO3),若能,则w(NaHCO3)的计算式为:(若不能,此问不作答。)
某学生做同主族元素性质递变规律的实验时,自己设计了一套实验方案,并记录了有关实验现象。现在请你帮助该学生整理并完成实验报告。
(1)实验目的:探究同一主族元素性质的递变规律。
(2)实验用品:药品:氯水、溴水、溴化钠溶液、碘化钾溶液、四氯化碳。
仪器:①__________;②__________。(请填写两件主要的玻璃仪器)
(3)实验内容:
| 序号 |
实验方案 |
实验现象 |
| ① |
将少量氯水滴入盛有少量NaBr溶液的试管中,振荡;再滴入少量四氯化碳,振荡 |
加入氯水后,溶液由无色变为橙色,滴入四氯化碳后,水层颜色变浅,四氯化碳层(下层)变为橙红色 |
| ② |
将少量溴水滴入盛有少量KI溶液的试管中,振荡;再滴入少量四氯化碳,振荡 |
加入溴水后,溶液由无色变为黄色,滴入四氯化碳后,水层颜色变浅,四氯化碳层(下层)变为紫色 |
(4)实验结论:____________________________________。
(5)问题和讨论:①请用结构理论简单说明得出上述结论的原因:。
②由于F2过于活泼,很难设计一个简单的实验验证其氧化性强弱。试列举两项事实说明F的非金属性比Cl强:;。
为测定某有机化合物A的结构,进行如下实验:
(一)分子式的确定:
(1)将有机物A置于氧气流中充分燃烧,实验测得:生成5.4g H2O和8.8g CO2,消耗氧气6.72L(标准状况下),则该物质中各元素的原子个数比是.
(2)用质谱仪测定该有机化合物的相对分子质量,得到如图①所示质谱图,则其相对分子质量为,该物质的分子式是.
(3)根据价键理论,预测A的可能结构并写出结构简式、.
(二)结构式的确定:
(4)核磁共振氢谱能对有机物分子中不同化学环境的氢原子给出不同的峰值(信号),根据峰值(信号)可以确定分子中氢原子的种类和数目.例如:甲基氯甲基醚(ClCH2OCH3)有两种氢原子如图②.经测定,有机物A的核磁共振氢谱示意图如图③,则A的结构简式为.
(三)性质实验:
(5)A在一定条件下脱水可生成B,B可合成包装塑料C,请写出B转化为C的化学方程式:.
(6)体育比赛中当运动员肌肉扭伤时,队医随即用氯乙烷(沸点为12.27℃)对受伤部位进行局部冷冻麻醉.请用B选择合适的方法制备氯乙烷,要求原子利用率为100%,请写出制备反应方程式:.
生活中有很多现象都蕴藏着化学秘密,如果你是一个细心的人,就一定会发现很多有趣的事.
(1)煤气灯曾是十八世纪的主要照明工具,但有一个奇怪的事引起了不少人的注意,那就是在有些煤气灯的附近,树叶比其他树要早落好长时间,但这个问题一直到1901年才由俄国的植物学家奈刘波夫证实是煤气灯产生的一种气体在作怪,你认为这种气体可能是.
(2)为了证明你的判断,如图1是一位同学做的实验及其装置: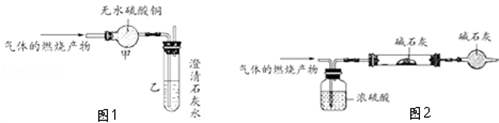
如果实验时无水硫酸铜变蓝色,澄清的石灰水变浑浊;你认为通过以上实验可以得出的结论是.
(3)若要进一步得出该分子的组成,如图2是另一个同学的实验及其装置.要达到实验的目的,需要下列哪些数据.
①此气体的质量
②浓硫酸的增重
③硬质玻璃管的增重
④干燥管的增重
⑤此气体的体积(标准状况下的)
(4)将这种气体在高温高压条件下与苯甲醛按一定比例混合,结果发现苯甲醛的质量和性质都没有发生变化,且还得到了一种白色固体.试推测苯甲醛的作用是.得到的白色固体是,发生的反应是(填反应类型).