(14分)
根据要求完成下列各小题实验目的。(a、b为弹簧夹,加热及固定装置已略去)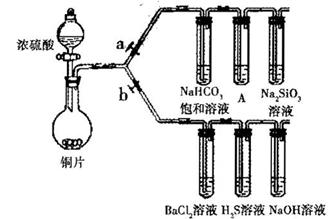
(1)验证碳、硅非金属性的相对强弱。(巳知酸性:亚硫酸 >碳酸)
①连接仪器. ________、加药品后,打开a关闭b,然后滴入滚硫酸,加热
②铜与浓硫酸反应的化学方程式是________________装置A屮的试剂是________
③能说明碳的非金属性比硅强的实验现象是:________
(2)验证 SO,的氧化性.、还原性和酸性氧化物的通性。
①打开b,关闭a。
②H2S溶液中宥浅黄色浑浊出现,化学方程式是:_____
③BaCl2溶液中无叨诚现象,将其分成两份,分別滴加下列溶液,将产生的沉淀的化学式填人下表相应位置
| 滴加的溶液 |
氯水 |
氨水 |
| 沉淀的化学式 |
|
|
写出其中SO2 显示 还原性并生成沉淀的离子方程式_________
还原性并生成沉淀的离子方程式_________
某同学用如图一所示的装置来探究CO2、SO2与澄清石灰水的反应,结果通入CO2可以看到先浑浊后澄清的现象,但通入SO2没有看到浑浊现象。经过思考分析,该同学改用图二的装置,将气体收集在注射器中,缓慢地将气体一个气泡一个气泡地通入澄清石灰水中,结果都能看到石灰水先变浑浊再澄清的现象,且通入SO2产生的现象明显比通入CO2快。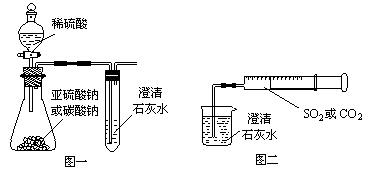
(1)若锥形瓶内装的是亚硫酸钠,写出锥形瓶内反应的化学方程式:______________
______________________________。
(2)对比分析两组实验,你认为用图一装置实验时,通入SO2不能出现浑浊的原因可能是____________________________________。写出此时试管内发生反应的总化学方程式:____________________________________。
(3)用图二装置实验时,以相同速率通入CO2或SO2,SO2产生浑浊再变澄清的现象比CO2快,其原因是___________________________________________。
(4)用图一进行SO2与石灰水反应的实验时,为防止SO2污染空气,应用盛有过量浓烧碱溶液的容器吸收SO2,写出容器内发生反应的离子方程式:____________________。
重晶石填料的生产工艺流程为:

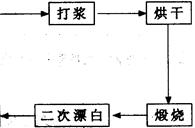
(1)在该流程中,为加快“漂白”速度,采取的措施有。
(2)硫酸起到了“漂白”的作用。请写出硫酸直接起到该作用时的化学方程式:
。
(3)铝粉也起到了“漂白”的作用。你认为,铝粉是如何起到该作用的?
。
(4)有同学认为,既然两次水洗,那么铝粉的作用就不大。你的解释是:
。
(5)煅烧的主要目的是。
(6)将煅烧后的固体磨细,使用的是加有刚玉(氧化铝)球的振动磨。这说明刚玉具有很高的。
①电解池中电极反应的方程式是
阴极:,阳极:。
②写出生成氯酸钾的离子方程式,并标明电子转移的方向和数目。
第二种,无隔膜电解热的氯化钠水溶液,然后用电解后溶液中的一种产物与等物质的量的氯化钾水溶液混合制得氯酸钾。
③第二种方法中制得氯酸钾的化学方程式是,该反应能够进行的原因是。
④已知下列各物质的价格如下表:
| 物质 |
NaCl |
KCl |
NaClO3 |
KClO3 |
KOH |
| 价格(元/50kg) |
500 |
1900 |
4200 |
26000 |
10600 |
从经济效益分析,上述方法中的第种方法更好,理由是
。
5 Fe2+ +5C2O42—+3MnO4—+24H+="=5" Fe3+ +10CO2↑+3Mn2++12H2O
实验方案设计为:
①将准确称量的a g草酸亚铁样品置于250mL锥形瓶内,加入适量2 mol/L的H2SO4溶液,使样品溶解,加热至70℃左右,立即用浓度为0.02000 mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为b mL
②向上述滴定混合液中加入适量的Zn粉和过量的2 mol/L的H2SO4溶液,煮沸5—8min,经检验溶液合格后,继续用0.02000 mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为c mL
③。
④数据处理。
请回答下列问题:
(1)上述实验方案中的步骤③是。
(2)洁净的滴定管在滴定前必须进行的操作是:
Ⅰ、检验活塞是否漏水。
Ⅱ、。
Ⅲ、加入高锰酸钾标准溶液,赶走尖嘴部位的气泡,调节起始读数。
(3)步骤②中检验溶液是否合格的操作是:取1滴煮沸后的溶液滴入装有溶液的试管中,如,则说明溶液合格。
(4)某小组的一次测定数据记录如下:
| a/g |
起始读数/mL |
b/mL |
c/mL |
| 0.1970 |
0.00 |
31.30 |
42.40 |
根据数据计算0.1970g 样品中:n(Fe2+)==; n(C2O42—)==;
FeC2O4的质量分数为(精确到0.01%)
(1)实验室可用甲酸与浓硫酸共热制备一氧化碳:HCOOH浓硫酸========H2O+CO↑,实验的部分装置如下图所示。制备时先加热浓硫酸至80℃—90℃,再逐滴滴入甲酸。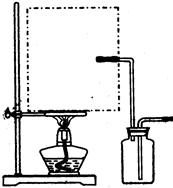

Ⅰ制备COⅡⅢ收集CO
①从下图挑选所需的仪器,画出Ⅰ中所缺的气体发生装置(添加必要的塞子、玻璃管、胶皮管,固定装置不用画),并标明容器中的试剂。




分液漏斗长颈漏斗蒸馏烧瓶集气瓶温度计
②装置Ⅱ的作用是。
(2)实验室可用甲酸制备甲酸铜。其方法是先用硫酸铜和碳酸氢钠作用制得碱式碳酸铜,然后再与甲酸斥制得四水甲酸铜[Cu(HCOO)2·4H2O]晶体。相关的化学方程式是:
2CuSO4+4 NaHCO3="=" Cu(OH)2·CuCO3↓+3CO2↑+2Na2SO4+H2O
Cu(OH)2·CuCO3+4HCOOH+ 5H2O="=2" Cu(HCOO)2·4H2O+ CO2↑
实验步骤如下:
Ⅰ、碱式碳酸铜的制备: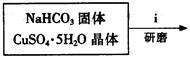
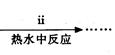
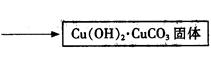
③步骤ⅰ是将一定量CuSO4·5H2O晶体和NaHCO3固体一起放到研钵中研磨,其目的是。
④步骤ⅱ是在搅拌下将固体混合物分多次缓慢加入热水中,反应温度控制在70℃—80℃,如果看到(填写实验现象),说明温度过高。
Ⅱ、甲酸铜的制备:
将Cu(OH)2·CuCO3固体放入烧杯中,加入一定量热的蒸馏水,再逐滴加入甲酸至碱式碳酸铜恰好全部溶解,趁热过滤除去少量不溶性杂质。在通风橱中蒸发滤液至原体积的1/3时,冷却析出晶体,过滤,再用少量无水乙醇洗涤晶体2—3次,晾干,得到产品。
⑤“趁热过滤”中,必须“趁热”的原因是。
⑥用乙醇洗涤晶体的目的是。