下面是实验室制取氧气、氢气、二氧化碳的装置图,根据装置图回答下列问题:

(1)写出标有①、②序号的仪器的名称:①____ ②____
(2)实验室制取氧气时,可选用的发生装置是____;因为氧气不易溶于水,所以可用____装置收集(写装置代号以下同)
(3)实验室收集氢气时,可选用的装置是____和____。
(4)装置B是实验室制取____和____气体的发生装置。
某中学化学研究性学习小组利用以下装置制取并探究氨气的性质。A中发生反应的化学方程式: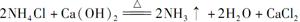
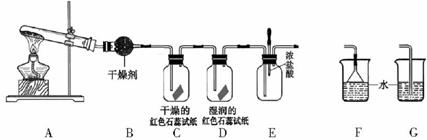
【实验探究】
(1)A中的反应(填“是”或“不是”)氧化还原反应。
(2)A装置还可用于制取气体(只填一种)
(3)若有10.7gNH4Cl固体,最多可制取NH3(标准状况)的体积是L (NH4C1的摩尔质量为53.5g·mol-1)。
(4)实验室收集氨气的方法是
(5)C、D装置中颜色会发生变化的是(填“C”或“D”)
(6)当实验进行一段时间后,挤压E装置中的胶头滴管,滴人1-2滴浓盐酸,可观察到的现象是
(7)为防止过量氨气造成空气污染,需要在上述装置的末端增加一个尾气处理装置,合适的装置是(填“F”或“G”)。
【知识拓展】
(8)生石灰与水反应生成Ca(OH)2并放出热量[化学方程式为CaO+H2O==Ca(OH)2]。实验室利用此原理,往生石灰中滴加浓氨水,可以快速制取氨气。你认为生石灰可用下列物质代替(填序号)。
A.碱石灰(NaOH与CaO的固体混合物) B.NaOH 固体
C.硫酸溶液 D.石灰石(含CaCO3)
【知识应用】
(9)2010年11月9日晚,我省宁德市一冷冻厂发生氨气泄漏事件,500 多居民深夜大转移。假如你在现场,你会采用什么自救为法?
某中学研究性学习小组为探究碳酸钠和碳酸氢钠两种物质的性质、制法和用途,进行了如下实验:
实验一、如图Ⅰ~Ⅳ所示。
(1)若用实验Ⅳ来验证碳酸钠和碳酸氢钠的热稳定性,则试管B中装入的固体最好是,能说明碳酸钠比碳酸氢钠稳定的实验现象是。
(2)若用实验来鉴别碳酸钠和碳酸氢钠两种固体,能达到实验目的的是(填装置序号)。其中能够说明泡沫灭火器中选择碳酸氢钠与酸反应制CO2而不选择碳酸钠的实验是。
(3)若测定Na2CO3固体中混有的少量NaHCO3的质量分数,采用实验Ⅲ能否达到实验目的?若能,请说明其计算所需的数据;若不能,请简要说明理由。
实验二、将碳酸氢钠溶液与澄清石灰水混合并充分反应。
(4)当石灰水过量时,反应的离子方程式为。
(5)当碳酸氢钠与氢氧化钙物质的量之比为2:1时,所得溶液中溶质的化学式为。
实验三、(6)检验“侯氏制碱法”制得的纯碱中是否混有食盐所需的试剂是;
(I)下列有关实验的叙述中,合理的是(填序号)
| A.用CCl4萃取碘水中的碘,分液时,有机层从分液漏斗下口放出 |
| B.不宜用瓷坩埚灼烧氢氧化钠或碳酸钠 |
| C.将l0 g ZnSO4·7H2O溶解在90 g水中配制10%的ZnSO4溶液 |
| D.向某溶液中加氯化钡溶液,产生不溶于稀硝酸的白色沉淀,则该溶液中一定含有SO42— |
E.配制一定物质的量浓度的溶液,定容时俯视容量瓶的刻度线,会使所配溶液浓度偏高
(II)二氯化硫(SCl2)熔点—78℃,沸点59℃。密度1.638g/mL。遇水易分解。二氯化硫与三氧化硫作用可生成重要化工试剂亚硫酰氯(SOCl2)。以下是由氯气与硫反应合成二氯化硫的实验装置。
试回答下列:
(1)装置A中反应的离子方程式为:。
(2)装置B盛放的药品是;C中是。
(3)实验开始前先在D中放入一定量的硫粉,加热使硫熔化,然后转动和摇动烧瓶使硫附着在烧瓶内壁形成一薄层表面,这样做的目的是。
(4)实验时,D装置需加热至50—59 oC,最好采用何种方式加热。
(5)F装置中干燥管内所盛物质是,作用是:。
(6)由二氯化硫与SO3作用生成亚硫酰氯的化学方程式为:。
实验室需要0.80mol/LNaOH溶液475mL和0.40mol/L硫酸溶液500mL。根据这两种溶液的配置情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是(填序号),配制上述溶液还需用到的玻璃仪器是(填仪器名称)。
(2)下列操作中,容量瓶所不具备的功能有(填序号。)
| A.配制一定体积准确浓度的标准溶液 |
| B.量取一定体积的液体 |
| C.测量容量瓶规格以下的任意体积的液体 |
| D.准确稀释某一浓度的溶液。 |
E.贮存溶液
F.用来加热溶解固体溶质
(3)根据计算得知,所需质量分数为98%、密度为1.84 g/cm3的浓硫酸的体为mL(保留一位小数)。如果实验室有10mL、15mL、20mL、50mL量筒,应选用mL量筒最好。
(4)根据计算用托盘天平称取NaOH的质量为g。在实验中其他操作均正确,若定容时俯视视刻度线,则所得溶液浓度0.8 mol/L(填“大于”、“等于”或“小于”,下同)。若定容时,有少许蒸馏水洒落在容量瓶外,则所得溶液浓度0.8 mol/L。
实验是进行科学探究的重要途径,也是学习科学知识的主要手段之一。请回答下列有关问题:
(1)在实验室若用C装置制备氨气,其化学方程式为_____________________________________,若采用D装置制备氨气,那么所选药品是________________________。
(2)若用二氧化锰和浓盐酸来制取干燥、纯净的氯气,其离子反应方程式是,仪器装置连接顺序是AFEGJ,其中F的作用是。
(3)B、H、J连接后,在B中盛装浓硝酸和铜片,以制得并进行NO2的有关实验。
①写出B中反应的化学方程式____________________________________________。
②欲用H装置验证NO2与H2O的反应,操作步骤为:先关闭止水夹a、b,再打开止水夹c,使烧杯中的水进入具支试管的可能的操作是_________________________________。