下图所示装置为铜跟浓硫酸反应制取二氧化硫的实验装置,请回答下列问题:
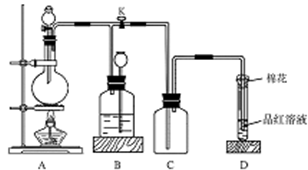
Ⅰ.(1)在装置A中放入有关药品后,打开活塞K,将分液漏斗中的液体加入烧瓶中,关闭分液漏斗的活塞,点燃酒精灯,烧瓶中反应的化学方程式为:__________________。
(2)装置D中试管口放置的棉花中应浸有一种液体,这种液体是 ,其作用是___________________。
(3)装置B的作用是贮存多余的二氧化硫和防止其污染环境,则B中应盛放的液体是 (填写字母代号)
a.水 b.浓溴水
c.KMnO4酸性溶液 d.NaHSO3饱和溶液
Ⅱ.为了验证木炭和浓H2SO4反应生成了SO2和CO2,有人设计了以下实验。
(提示:酸性高猛酸钾溶液可把SO2氧化成H2SO4, 试剂可以重复使用)
(4)各装置中盛放的试剂是(填序号):
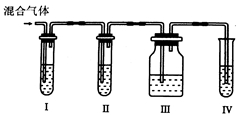
Ⅰ_______ Ⅱ_______ Ⅲ_______ Ⅳ_______
| A.品红溶液 | B.NaOH溶液 | C.澄清石灰水 | D.高锰酸钾溶液 |
(5)能说明SO2存在的现象是________________________________________。
(6)使用装置Ⅱ的目的是___________________________________________。
(7)使用装置Ⅲ的目的是 。
(8)确认含有CO2的现象是 。
(本题共12分)某兴趣小组用合金铝、铁、铜的废弃合金为原料制取硝酸铜晶体和氢氧化铝,并测定硝酸铜晶体的结晶水含量和氢氧化铝的纯度,设计的主要流程如下: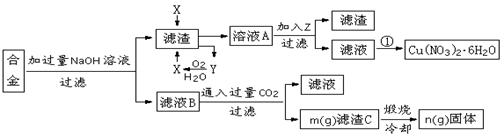
已知:
Fe2+沉淀的pH范围为7.0~9.0;Fe3+沉淀的pH范围为1.9~3.2;Cu2+沉淀的pH范围为4.7~6.7
回答下列问题:写出合金中加入NaOH溶液后所发生的离子反应方程式_______________________。试剂X的名称为______________。
加入Z的作用是调节溶液的pH,pH范围应为_____;下列可作为试剂Z的是_______。
a.铜粉b.氨水c.氧化铜d.硫酸铜实验操作①依次是_________、_________、过滤洗涤即可得硝酸铜晶体。
测定硝酸铜晶体的结晶水含量,下列方案中肯定不可行的是 。(选填编号)
a.称量样品→加热→冷却→称量CuO
b.称量样品→加热→冷却→称量Cu(NO3)2
c.称量样品→加热→用已知质量的无水氯化钙吸收水蒸气并称量
d.称量样品→加过量已知量的NaOH溶液→选用酚酞指示剂用标准盐酸滴定根据流程图内数据计算:滤渣C中氢氧化铝的质量分数为______________________。(用m、n的代数式表示)
按该流程的操作步骤,氢氧化铝质量分数的测定结果偏高的可能性是最大的,原因有_______________________________;____________________________________。
利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实.某化学兴趣小组拟在实验室中模拟上述过程,其设计的模拟装置如下:
根据要求填空:
(1)装置A中反应的化学方程式为,当产生336mL气体(标准状况)时,有mol还原剂被氧化。
(2)B装置有三种功能:①控制气流速度;②_______;③________________。
(3)设V(Cl2)/V(CH4)=x,若理论上欲获得最多的氯化氢,则x的取值范围是______。
(4)D装置中的石棉上均匀附着湿润的KI粉末,其作用是_______________________。
(5)E装置的作用是____________(填编号)。
A.收集气体B.吸收氯气 C.防止倒吸 D.吸收氯化氢
(6)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出置换出黑色小颗粒的化学方程式_______________________________。
(7)装置中除了有盐酸生成外,还含有有机物,从E中分离出盐酸的最佳方法为_______。该装置还有缺陷,原因是没有进行尾气处理,其尾气的主要成分是__________(填编号)。
A.CH4
B.CH3Cl
C.CH2Cl2
D.CHCl3
E.CCl4
已知铁离子,氯气、溴均为常见的氧化剂,某化学兴趣小组设计了如下实验探究其强弱: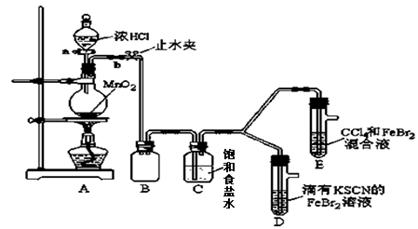
(1)①装置A中发生反应的离子方程式是。
②整套实验装置存在一处明显的不足,请指出。
(2)用改正后的装置进行实验,实验过程如下:
| 实验操作 |
实验现象 |
结论 |
| 打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后 。 (填具体实验操作) |
D装置中:溶液变红 E装置中:水层溶液变黄, 振荡后,下层CCl4层无明显变化。一段时间后。(填实验现象) |
Cl2、Br2、Fe3+的氧化性由强到弱的顺序为: Cl2>Br2>Fe3+ |
(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化。
D装置中:红色慢慢褪去。
E装置中:CCl4层颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
ⅰ.Fe3+ +3SCN- Fe(SCN)3是一个可逆反应。 Fe(SCN)3是一个可逆反应。ⅱ.(SCN)2性质与卤素单质类似。氧化性:Cl2 > (SCN)2。 |
①请用平衡移动原理(结合上述资料)解释Cl2过量时D中溶液红色褪去的原因。
现设计简单实验证明上述解释:取少量褪色后的溶液,滴加溶液,若溶液颜色。则上述解释是合理的。
小组同学另查得资料如下:
| ⅲ.Cl2和Br2反应生成BrCl,BrCl呈红色(略带黄色),沸点约5℃,它与水能发生水解反应,且该反应为非氧化还原反应。 ⅳ.AgClO、AgBrO均可溶于水。 |
②欲探究E中颜色变化的原因,设计实验如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合上述资料用两步离子方程式解释仅产生白色沉淀原因、。
实验室里用加热正丁醇、溴化钠和浓硫酸的混合物的方法来制备1—溴丁烷时,还会有溴、烯和醚等产物生成。反应结束后将反应混合物蒸馏,分离得到1—溴丁烷。已知有关物质的性质如下:
| 熔点/℃ |
沸点/℃ |
密度/g·cm-3 |
|
| 正丁醇 |
-89.53 |
117.25 |
0.81 |
| 1—溴丁烷 |
-112.4 |
101.6 |
1.28 |
| 丁醚 |
95.3 |
142 |
0.76 |
| 1—丁烯 |
-185.3 |
-6.5 |
0.59 |
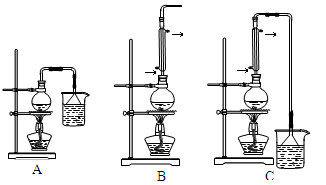
(1)生成1—溴丁烷的反应装置应选用上图中的 (填序号),反应加热时温度t1应控制在 100℃。
(2)生成1—溴丁烷的化学方程式为 。
(3)反应中由于发生副反应而生成副产物的反应类型依次有(按生成溴、烯、醚的先后顺序) 。
(4)反应结束后,将反应混合物中1—溴丁烷分离出,应采用方法是 ,该操作应控制温度t2的范围是 。
(5)在最后得到的1—溴丁烷的产物中,可能含有的杂质主要是 ,进一步除去的方法是 。
(6)在分液漏斗中用一种有机溶剂提取水溶液里的某物质时,静置分层后,欲知哪一层液体是“水层”,其简便的判断方法是 。
某实验小组模拟“侯氏制碱法”制纯碱,并进行以下探究:
(1)检验纯碱样品中是否混有NaHCO3,请选择下列装置设计实验,并完成下表:
| 选择的装置 (填编号) |
实验现象 |
实验结论 |
| 样品含 NaHCO3 |
(2)测定该纯碱样品的纯度:称取m1g样品,置于小烧杯中,加水溶解,滴加足量CaCl2溶液。将反应 混和物过滤、(填操作)、干燥、称量为m2g。该纯碱样品的纯度为。
(3)该小组同学在0.1mol/LNaHCO3溶液中滴加酚酞溶液1滴,溶液没有什么变化,但加热后显淡红色,加热较长时间后冷却,红色不褪去。为探究原因,进行了下列实验:
实验1:加热0.1mol/LNaHCO3溶液,测得溶液pH变化如下表
| 温度(℃) |
10 |
20 |
30 |
50 |
70 |
80 |
100 |
| pH |
8.3 |
8.4 |
8.5 |
8.9 |
9.4 |
9.6 |
10.1 |
但当温度恢复到10℃,测得溶液pH=9.8。
实验2:加热0.1mol/LNaHCO3溶液,将产生的气体通入澄清石灰水,澄清石灰水变浑浊。
①用离子方程式表示0.1mol/LNaHCO3溶液中存在的平衡(除水电离平衡外)、_________。这两个平衡以__________为主。
②结合实验1、2分析,加热0.1mol/LNaHCO3溶液,pH增大的原因可能是________________(答一条)。