由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、NH4+、Mg2+、Ba2+、C1—、SO42—、CO32-。将该混合物溶于水后得澄清溶液,现取3份100mL该溶液分别进行如下实验:
| 实验序号 |
实验内容 |
实验结果 |
| 1 |
加AgNO3溶液 |
有白色沉淀生成 |
| 2 |
加足量NaOH溶液并加热 |
收集到气体1.12L(已折算成标准 状况下的体积) |
| 3 |
加足量BaC12溶液时,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 |
第一次称量读数为6. 27g,第二次 称量读数为2.33g |
试回答下列问题:
(1)根据实验1对C1—是否存在的判断是 (填“一定存在”、“一定不存在”或“不能确定”);根据实验1~3判断混合物中一定不存在的离子是 。
(2)试确定溶液中一定存在的阴离子及其物质的量浓度(可不填满):
| 阴离子符号 |
物质的量浓度(mol·L—1) |
| |
|
| |
|
(3)试确定K+是否存在? ,判断的理由是
Ⅰ.某实验小组对H2O2的分解做了如下探究。下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15 ml 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
| MnO2 |
触摸试管情况 |
观察结果 |
反应完成所需的时间 |
| 粉末状 |
很烫 |
剧烈反应,带火星的木条复燃 |
3.5 min |
| 块状 |
微热 |
反应较慢,火星红亮但木条未复燃 |
30 min |
(1)写出大试管中发生反应的化学方程式:,该反应是反应(填放热或吸热)。
(2)实验结果表明,催化剂的催化效果与有关。
Ⅱ.某可逆反应在某体积为5L的密闭容器中进行,在从0—3分钟各物质的量的变化情况如图所示(A,B,C均为气体)。
(3)该反应的的化学方程式为;
(4)反应开始至2分钟时,B的平均反应速率为。
(5)能说明该反应已达到平衡状态的是。
a.v(A)= 2v(B)
b.容器内压强保持不变
c.2v逆(A)= v正(B)
d.容器内混合气体的密度保持不变
(6)在密闭容器里,通入a mol A (g)、b mol B (g)、c molC(g),发生上述反应,当改变下列条件时,反应速率会减小的是。
A.降低温度B.加入催化剂C.增大容器体积
Ⅲ.(7)为了减缓Zn与盐酸产生氢气的反应速率而又不减少产生氢气的量,在盐酸中分别加入下列物质:
A.H2O
B.NaCl溶液
C.Na2CO3溶液
D.Cu粉
E.CuSO4粉末
你认为可行的是(填编号)。
某研究性学习小组设计实验验证氨气与二氧化硫的性质。请你完成下列研究:
(一)氨气性质探究
(1)实验室制备氨气,下列方法中可选用的是(填编号)
①加热浓氨水;②固体生石灰中滴加浓氨水;③固态氯化铵加热分解;④固态硝酸铵加热分解;
(2)该小组成员设计实验探究氨气还原性及产物,提供实验装置如下:
(3)请你根据提供的装置从左至右连接接口序号()()()()()()
(4)该装置在设计上有一定的缺陷,为确保实验结果的准确性,你对该装置的改进措施是________________;
(5)利用改进后的装置进行实验,观察到CuO全部变为红色物质,无水CuSO4变蓝,同时生成一种无污染的气体。请写出NH3与CuO反应的化学方程式________________;
(6)装置B的作用是:________________;
(二)二氧化硫性质探究
下图是实验室制取SO2并验证SO2的某些性质的装置,试回答: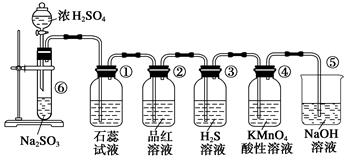
(1)盛放浓硫酸仪器的名称:_________________;
(2)若将浓硫酸改用浓硝酸能否完成此实验探究?答:____________,请写出改用浓硝酸后⑥中的离子反应方程式:_____________________________________
(3)②实验现象为:_________________,证明SO2具有________性;
(4)若③中的试剂改为Na2S溶液,实验现象与原溶液是否相同:______________,含有1mol Na2S的水溶液最多可以吸收SO2的物质的量为:________。
(5)④中发生的离子反应为:_______________________________________。
资料显示:“氨气可在纯氧中安静燃烧……某校化学小组学生设计如下装置(图中铁夹等夹持装置已略去)进行氨气与氧气在不同条件下反应的实验。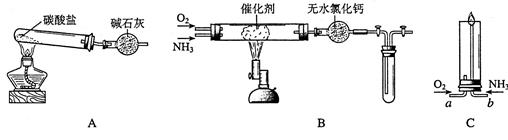
(1)用装置A制取纯净、干燥的氨气,大试管内碳酸盐的化学式是;碱石灰的作用是。
(2)将产生的氨气与过量的氧气通到装置B(催化剂为铂石棉)中,用酒精喷灯加热:
①氨催化氧化的化学方程式是试管内气体变为红棕色,该反应的化学方程式是
②停止反应后,立即关闭B中两个活塞。一段时间后,将试管浸入冰水中。试管内气体颜色变浅,请结合化学方程式说明原因
(3)将过量的氧气与A产生的氨气分别从A、B两管进气口通人到装置C中,并在B管上端点燃氨气,两气体通入的先后顺序是:先通入______(O2 ,NH3 ),后通入__________(O2,NH3)其理由是
某课外活动小组的同学,在实验室做锌与浓硫酸反应的实验时,方方同学认为产生的气体除SO2外,还可能产生氢气。该同学为了验证他的判断是否正确,设计了如图所示的实验装置,其中,装置B中盛有浓硫酸,装置C中放置黑色CuO粉末,装置D中放置的是无水硫酸铜粉末(锌与浓硫酸共热时产生的气体为X,且该装置略去)。试回答: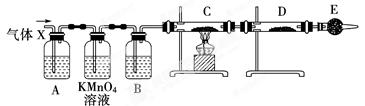
(1) E中加入的试剂是碱石灰,作用是_____________;装置A、B之间的酸性高锰酸钾溶液的作用是_________________;
(2)上述反应中生成二氧化硫的化学方程式为___________________________________;
(3)如果去掉装置B,就不能根据D中的现象判断气体X中有氢气,原因是:_______________________。
(4可以证明气体X中含有氢气的实验现象是:
C中______________________________,D中_______________________。
(14分)某学习小组同学探究FeSO4的化学性质和用途。
(一)利用下图装置探究FeSO4的稳定性和用途。(绿矾成分为FeSO4·7H2O)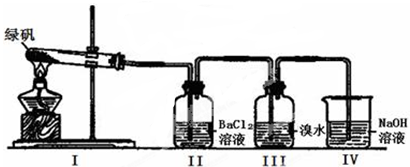
(1)II中有白色沉淀生成,说明FeSO4固体分解生成了_____________。
(2)III中溴水是用来检验是否有SO2气体生成,涉及的化学方程式为_________________,实验中,观察到溴水褪色,据此推测FeSO4分解最有可能被氧化的元素是______________。
(3)Ⅳ中足量NaOH溶液的作用是吸收SO2气体,防止其污染环境,请写出反应的离子方程式___________。
(二)探究FeSO4中Fe2+的还原性
(4)证明FeSO4有较强的还原性,完成下表步骤二及其现象。
(三)硫酸亚铁用途探究
(5)缺铁性贫血往往口服硫酸亚铁,当用硫酸亚铁制成药片时,外表包有一层特殊的糖衣,其作用是_______________________。