某溶液中可能含有Na+、K+、Mg2+、I—、SO32—、SO42—等离子中的全部或其中的几种。现分别进行以下实验操作:
①用洁净的铂丝蘸取溶液在无色火焰上灼烧,焰色呈黄色;②取原溶液,滴加少量溴水,振荡后溶液仍为无色。③取原溶液,加入盐酸酸化的Ba(NO3)2溶液后,产生白色沉淀。
(1)原溶液中一定存在的离子是 ,一定不存在的离子是 。
(2)上述①~③,的操作中, 是错误的,应改为 ,以便确定 离子的存在。
(3)为确定 离子是否存在,应补充的实验是①
② 。
四种短周期元素在周期表中的位置如图,其中只有M为金属元素。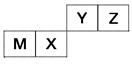
请回答下列问题:
(1)这些元素的氢化物中,水溶液碱性最强的是________(写化学式),该氢化物的电子式为________。
(2)元素X和元素Y的最高价氧化物对应水化物的酸性较弱的是________,列举一个化学方程式证明________________________。
(3)元素Z与元素M组成的化合物中所含化学键类型为________,元素Z与元素X组成的化合物中所含化学键类型为________。
某校同学为探究Br2、I2和Fe3+的氧化性强弱,进行了如下实验。
实验①:取少量KI溶液于试管中,先加入溴水、振荡,再加入CCl4,振荡后静置,观察到下层液体呈紫红色;
实验②:取少量FeSO4溶液于试管中,先加入溴水,振荡,再继续滴加两滴KSCN溶液,振荡,观察到溶液呈红色。
(1)写出离子方程式:
实验①:__________________________________________________________;
实验②:__________________________________________________________。
(2)由上述两个实验,对物质的氧化性可以得出的正确结论是________。
| A.Br2>I2 | B.Fe3+>Br2 |
| C.Br2>Fe3+ | D.I->Br- |
(3)已知Fe3+的氧化性强于I2,请你从所给试剂中选择所需试剂,设计一个实验加以证明。(提示:请写出实验步骤、现象及结论)
①FeCl3溶液 ②碘水 ③KI溶液 ④稀H2SO4 ⑤淀粉溶液
__________________________________________________________________
__________________________________________________________________
氧化还原反应中实际上包含氧化和还原两个过程,下面是一个还原过程的反应式:NO3-+4H++3e-=NO+2H2O,KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的化学方程式:________________________。
(2)反应中硝酸体现了________、________的性质。
(3)反应中若产生0.2 mol气体,则转移电子的物质的量是________mol。
(4)若1 mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是_________________________________________________________________。
已知四种强电解质溶液,分别含有下列阴、阳离子中的各一种,并且互不重复:NH4+、Ba2+、Na+、H+、SO42-、NO3-、OH-、SO32-。将这四种溶液分别标记为A、B、C、D,进行如下实验。
①在A或D中滴入C,均有沉淀生成;
②D和B反应生成的气体能被A吸收;
③A和D反应生成的气体能被B吸收,也可使溴水褪色。
试回答下列问题:
(1)D的化学式是________,判断理由是___________________________________________。
(2)写出其余几种物质的化学式:A________,B________,C________。
(3)写出实验②中有关反应的离子方程式_______________________________。
(4)写出③中生成的气体与溴水反应的离子方程式_______________________。
标准状况下336 L的NH3溶于1 L水中,所得溶液的质量分数为________,若该溶液的密度为a g/cm3,则物质的量浓度为________。将上述氨水全部转化为NH4Cl,所需4 mol·L-1的盐酸的体积为________。