 我国中医药已逐步进入国际市场,但国外在进口中药时对中草药中的重金属元素和有毒元素的含量等各项指标检查是非常严格的。下面是某分析实验室对中草药中可能的残余有毒元素As的检验方法和步骤(As在中草药中主要以As2O3的形式存在):
我国中医药已逐步进入国际市场,但国外在进口中药时对中草药中的重金属元素和有毒元素的含量等各项指标检查是非常严格的。下面是某分析实验室对中草药中可能的残余有毒元素As的检验方法和步骤(As在中草药中主要以As2O3的形式存在): ①取1.000 kg中草药样品进行灼烧、溶解、过滤等操作制得待测溶液,此时样品中可能含有的As元素将转化为H3AsO3;
①取1.000 kg中草药样品进行灼烧、溶解、过滤等操作制得待测溶液,此时样品中可能含有的As元素将转化为H3AsO3; ②将待测溶液转移入250 mL锥形瓶中,并加入2~3滴0.2%的淀粉溶液;
②将待测溶液转移入250 mL锥形瓶中,并加入2~3滴0.2%的淀粉溶液; ③用标准碘溶液滴定待测溶液至终点,消耗20.25 mL标准I2溶液,其间发生反应:
③用标准碘溶液滴定待测溶液至终点,消耗20.25 mL标准I2溶液,其间发生反应: H3AsO3+I2+H2O―→H3AsO4+I-+H+(未配平)
H3AsO3+I2+H2O―→H3AsO4+I-+H+(未配平) 试回答下列问题:
试回答下列问题: (1)过滤时需用的玻璃仪器是: 。
(1)过滤时需用的玻璃仪器是: 。 (2)配平离子反应方程式:[ ]H3AsO3+[ ]I2+[ ]H2O===[ ]H3AsO4+[ ]I-+[ ]H+
(2)配平离子反应方程式:[ ]H3AsO3+[ ]I2+[ ]H2O===[ ]H3AsO4+[ ]I-+[ ]H+ (3)判断滴定到达终点的现象是: 。
(3)判断滴定到达终点的现象是: 。 (4)题中所用标准碘溶液并非将碘单质直接溶解于蒸馏水中制得,而是由0.107 0 g纯KIO3、过量的KI以及酸混合,并将其准确稀释到1 000 mL而制得,请用一个离子反应方程式说明标准碘溶液的形成过程: 。
(4)题中所用标准碘溶液并非将碘单质直接溶解于蒸馏水中制得,而是由0.107 0 g纯KIO3、过量的KI以及酸混合,并将其准确稀释到1 000 mL而制得,请用一个离子反应方程式说明标准碘溶液的形成过程: 。 (5)我国《药用植物及制剂进出口绿色行业标准》中限定:绿色中药的砷含量不超过2.000 mg/kg,计算可知该样品中砷含量约为 mg/kg,故该中草药样品 (填“合格”或“不合格”)。
(5)我国《药用植物及制剂进出口绿色行业标准》中限定:绿色中药的砷含量不超过2.000 mg/kg,计算可知该样品中砷含量约为 mg/kg,故该中草药样品 (填“合格”或“不合格”)。
将化学知识的系统化,有助于对化学问题的进一步认识。请你参与下列关于化学反应的讨论。
问题1:化学变化过程中的平衡状态可以通过改变反应条件而发生变化。对电离平衡、水解平衡、化学平衡等各种平衡移动的方向与外界条件变化的关系请你运用一句话进行总结:______________。
问题2:不同化学反应进行的快慢和程度千差万别。在复杂的反应中,要考虑反应的先后顺序。已知NH4++AlO2-+H2O=Al(OH)3↓+NH3·H2O,向含有等物质的量的NH4+、Al3+、H+、混合溶液中,慢慢滴加NaOH溶液,直至过量,并不断搅拌,依次发生了数个离子反应;其中
(1)第二个离子反应的离子方程式是
(2)最后一个离子反应的离子方程式是
问题3:化学反应的复杂性决定了反应方程式计量数的复杂性。对下列化学反应:
8KMnO4+15Kl+17H2SO4→8MnSO4+5I2+5KIO3+9 K2SO4+17H2O
如果该反应方程式中I2和KIO3的系数不是5,可能的配平系数还有许多组。请你再写出一个配平的该反应的化学方程式:。
问题4:1840年盖斯根据一系列实验事实得出规律:“若是一个反应可以分步进行,则各步反应的反应热总和与这个反应一次发生时的反应热相同。”这是在各反应于相同条件下完成时的有关反应热的重要规律。已知金刚石和石墨分别在氧气中完全燃烧的热化学方程式为:C(金刚石、s)+O2(g)=CO2(g):△H=-395.41kJ/mol,C(石墨、s)+O2(g)=CO2(g):△H=-393.51kJ/mol,则金刚石转化石墨时的热化学方程式为:。
1919年,Langmuir提出:原子数相同、电子数相同的分子,互称为等电子体。等电子体的结构相似、物理性质相近,称为等电子原理。后来,该原理被推广使用于一些具有特殊功能的晶体的发现和人工合成等诸多领域。如:X是一种新型无机材料,它与碳化硅(SiC)结构相似、物理性质相近,符合该原理。X有如下的转变:
其中:C是无色气体,D为自色沉淀,E溶液的焰色反应中火焰呈黄色。回答以下问题:
(1)写出X的化学式:_______,X属于______晶体(填“原子”、“分子”或“离子”)。
(2)写出X与A溶液反应的化学方程式:
写出常温下H与L反应的离子方程式:。
(3)X与SiC的复合粉末是新一代人规模集成电路的理想散热材料。最近日本科学家研究出一种新物质与氮气制备该纳米级复合材料的方法,请将该反应补充完整(方框中填新物质的化学式)。()+2N2 4X+SiC+3C。
4X+SiC+3C。
A、B都是芳香族化合物,1摩尔A水解得到1摩尔B和1摩尔醋酸。A、B的分子量都不超过200,完全燃烧都只生成CO2和H2O,且B分子中碳和氢元素总的质量百分含量为65.2%(即质量分数为0.652)。A的溶液具有酸性,不能使FeCl3溶液显色。
(1)A、B的分子量之差为
(2)1个B分子中应该有个氧原子
(3)A的分子式是
(4)B可能的三种结构简式是
碳正离子[例如,CH3+,CH5+,(CH3)3C+等]是有机反应中重要的中间体。欧拉(G.Olah)因在此领域研究中的卓越成就而获荣获1994年诺贝尔化学奖。碳正离子CH5+可以通过CH4在“超强酸”中再获得一个H+而得到;而CH5+失去H2,可以得到CH3+。
(1)CH3+是反应性很强的正离子,是缺电子的,其电子式是
(2)CH3+中4个原子时共平面,三个键角相等。键角应是___________
(3)(CH3)2CH+在NaOH的水溶液中反应将得到电中性的有机分子,其结构简式是。
(4)(CH3)3C+去掉H+后将生成电中性的有机分子,其结构简式是。
从物质A开始有如图所示的转化关系(其中部分产物已略去)。已知H能使溴的CCl4溶液褪色;1mol F(分子式C4H6O2)与足量新制的Cu(OH)2在加热条件下充分反应可生成2molCu2O。分析图表并回答问题: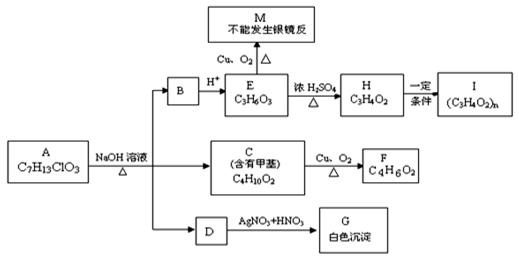
(1)A的结构简式:;
(2)写出反应类型:E→H、H→I;
(3)写出C→F的化学方程式:。
(4)请设计出由丙烯合成CH3—CH(OH)—COOH的反应流程图(有机物用结构简式表示,必须注明反应条件)。
提示:①合成过程中无机试剂任选;②反应流程图表示方法示例如下: